
当社は、医薬品や医療機器、メディカルフーズなどを扱う生命関連企業として、患者さんや医療従事者をはじめ皆さまに安心して製品を使っていただくことを第一に考え、製品の研究開発から生産、物流までの全ての段階で、品質を最優先にしています。法令や行政業界基準に準拠することはもちろん、製品ごとの特性に合わせた厳格な品質管理体制を構築しています。
生産部門や品質部門の一人一人が「医療の一端を担う」という高い使命感を持ち、皆さまに安全で安心かつ高品質な製品を安定してお届けするために、徹底した品質管理に取り組んでいます。

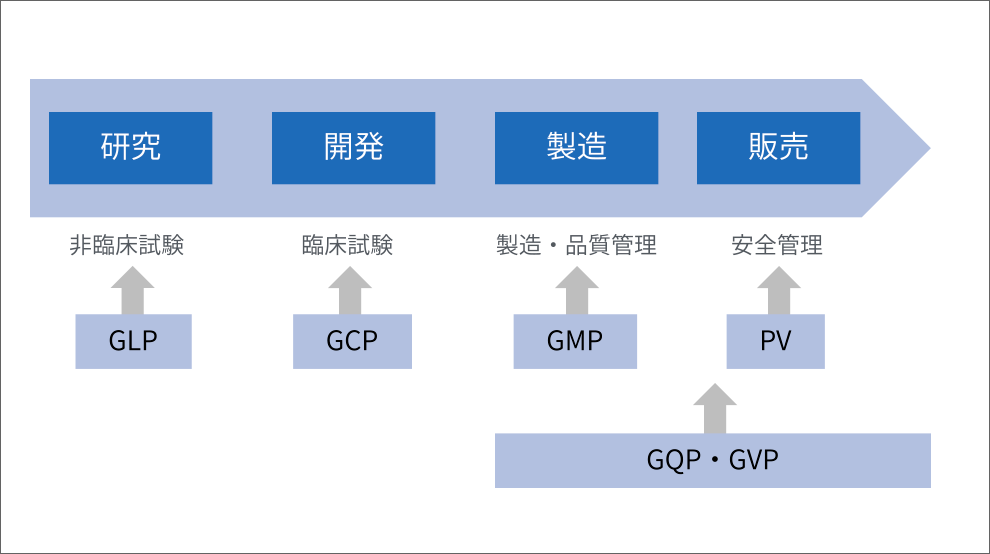
医薬品の研究開発においては、非臨床試験、臨床試験に関わる規制(GLP、GCP)に準拠し、医薬品となる候補物質の有効性だけでなく、その安全性の担保についても実証するとともに、適切なデータ管理により信頼性の向上を図っています。また、製造におけるGMP体制の構築、運用を通じ、製品の高い品質の維持および継続的な改善を目指しています。また、製造から販売を通じて、GQPやGVPに基づく品質管理、製造販売後の安全管理を行い、規制当局への報告や各種文書の整備、改訂を行っています。さらに、製品の安全性情報を絶えず収集・評価する安全性監視(PV)を行い、その結果を医療機関や販売会社に迅速にお届けする活動を続けています。
現在、世界各国で、医薬品の品質や安全性に対して、より厳格な基準を設ける動きが加速しており、そのなかでも、直接体内に投与される輸液には特に厳しい品質管理が求められています。当社は、日本の輸液のリーディングカンパニーとして、また海外に展開する大塚グループの輸液事業のマネジメントおよび技術協力を行う立場として、高いグローバル品質保証体制を構築し、主体的に運用しています。輸液事業を行うグループ会社16社において、安全性情報の交換体制を構築し、各国の法令、行政・業界基準の順守に加え、品質保証に対する考え方の統一を図りながら、一体となって、常に品質の維持・向上に努めています。

グローバル品質保証責任者会議
当社では、患者さん・ご家族や医薬関係者を始めとするステークホルダーからの各種のお問い合わせに対して、その内容に応じた専門部署が対応しています。さまざまな声に真摯に耳を傾け、丁寧に分かりやすく誠実にお答えするよう心がけています。お問い合わせから得た、安全性や品質にかかわる情報は速やかに担当部門に連絡し、リスクの監視や適正使用のための情報提供、製品の改善・開発に反映させています。

輸液DIセンターのオペレーター