- HOME
- よくある質問/お問い合わせ
- 医療用医薬品/医療機器
医療用医薬品(輸液、ラコール、ツインライン等)・医療機器に関するよくある質問と回答
- No.
- お問い合わせ
- 製品カテゴリ
- 項目
-
① 患者さん・ご家族にお渡しできる資料を、コーポレートサイト内の「患者さん・一般の皆様」向けのページ 1) に掲載しています。
- ○ 説明用資料
・ 在宅中心静脈栄養法 (HPN) の手引き
・ 静注用脂肪乳剤のご使用の手引き
・ 在宅経腸栄養法の手引き
・ はじめての半固形剤注入法の手びき
・ はじめようONS ! - ・ 間欠自己導尿を行う方へ
- ○ 製品の使用方法
・ エルネオパNF輸液の開通方法 - ・ 小室が残った場合の対処法
・ ラコールNF配合経腸用液 400mLバッグの使用方法
・ ツインラインNF配合経腸用液の使用方法
・ イノソリッド配合経腸用半固形剤、
ラコールNF配合経腸用半固形剤 注入方法のご紹介
(必要な器具と使用方法 説明書、動画など)
※ 上記以外の資料も掲載しています。(2025年8月現在)

② 医療スタッフ向けの資料は、医療関係者向け情報サイト2) に掲載しています。
- ○ 説明用資料
-
レバミピド錠100mg「オーツカ」は、AG ( オーソライズドジェネリック ) です。
成分 ( 原薬・添加物 ) 、製造方法、製造工場は先発医薬品と全て同じで、効能又は効果、用法及び用量も同じです。3.組成・性状1)

4.効能又は効果
・胃潰瘍
・下記疾患の胃粘膜病変 ( びらん、出血、発赤、浮腫 ) の改善
急性胃炎、慢性胃炎の急性増悪期
6.用法及び用量
〈胃潰瘍〉
通常、成人には 1回 1錠 ( レバミピドとして 100 mg ) を 1日 3回、朝、夕及び就寝前に経口投与する。
〈下記疾患の胃粘膜病変 ( びらん、出血、発赤、浮腫 ) の改善
急性胃炎、慢性胃炎の急性増悪期〉
通常、成人には 1回 1錠 ( レバミピドとして 100 mg ) を 1日 3回経口投与する。1) レバミピド錠100mg「オーツカ」電子添文 2021年10月改訂(第1版)
-
ツインラインNF配合経腸用液、ラコールNF配合経腸用液、イノラス配合経腸用液、ラコールNF配合経腸用半固形剤、イノソリッド配合経腸用半固形剤の水分含量(%)と一袋あたりの水分含量(mL)は下記の通りです。
製品名 水分含量 一袋あたりの水分量含量
(ツインラインはA液B液混合液として)ツインラインNF配合経腸用液 約85%1) 約340mL/400mL ラコールNF配合経腸用液 約85%2) 約170mL/200mL
約340mL/400mLイノラス配合経腸用液 約75%3) 約93mL/125mL
約140mL/187.5mLラコールNF配合経腸用半固形剤 約76%4) 約228mL/300g イノソリッド配合経腸用半固形剤 76%5) 228mL/300g 1) ツインラインNF配合経腸用液 電子添文 2022年4月改訂(第1版)
2) ラコールNF配合経腸用液 電子添文 2022年6月改訂(第1版)
3) イノラス配合経腸用液 電子添文 2023年5月改訂(第2版)
4) ラコールNF配合経腸用半固形剤 電子添文 2022年4月改訂(第1版)
5) イノソリッド配合経腸用半固形 電子添文 2024年11月改訂(第2版) -
隔壁開通後、室温室内散乱光下(約500lx)で2日後まで、冷暗所保管で7日後までは無色澄明でpHは4.5~6.5の範囲内であり、セファゾリンナトリウムの力価(残存率)は90%以上でした1)。
注意:本剤はキット製品(溶解液付き抗生物質製剤)であり、溶解後は速やかに使用することとしており、溶解後の品質を保証するものではありません。
1) セファゾリンNa点滴静注用1gバッグ「オーツカ」インタビューフォーム 2025年3月改訂(第12版)
-
ラコールNF配合経腸用半固形剤は、製剤の特性上、外観からは内容成分の変質が判断しにくいため、開封後の保存は避けてください。
開封後は、微生物汚染及び直射日光を避け、できるだけ早めに使い切ってください1)。【参考】
内容成分の安定性は、25±2℃,60±5%RH,800±100㏓で12時間まで規格内であることを確認しています 2)。1) ラコールNF配合経腸用半固形剤 電子添文 2022年4月改訂(第1版)
2) ラコールNF配合経腸用半固形剤 インタビューフォーム 2022年10月改訂(第6版) -
本剤に他剤を混注しないよう電子添文に以下の通り注意書き1)をしておりますので、配合変化試験は行っていません。
本剤に配合されている成分(電解質など)も混注できません。
本剤の性状(混合時:微黄色の乳濁液)上、外観で細菌汚染・配合変化を確認できず、また細菌が混入すると増殖しやすいためです。【参考】1)
14.適用上の注意
14.1全般的な注意(抜粋)
本剤は、含有する脂肪が目詰まりするため、除菌用ファイナルフィルターを使用できない。外観で細菌汚染・配合変化を確認できず、また、細菌が混入すると増殖しやすいため、以下の点に注意すること。
・本剤に他の薬剤を混注しないこと。
・本剤の輸液ラインの側管から他の薬剤を投与しないこと。1) エネフリード輸液 電子添文 2020年11月改訂(第2版)
2) Otsuka InformationVol.114 エネフリード輸液 他の薬剤を混注・側注しないでください -
エネフリード輸液は、光により分解が進むビタミンが含まれているため、遮光カバーを付けて投与してください。
14 適応上の注意1)
14.3.7 ビタミンの光分解を防ぐため、遮光カバーを用いるなど十分に注意すること。隔壁開通後の安定性2)
①遮光カバーがある場合
室温散乱光下(500lx)では、混合後 3 日までは、アセチルシステイン、リボフラビンリン酸エステルナトリウムおよびアスコルビン酸の含量は表示量の90%以上となり、脂肪粒子の粗大化による不溶性微粒子の増大は認められませんでした。②遮光カバーがない場合
室温散乱光下(500lx)では、混合後 24 時間までは、アセチルシステイン、リボフラビンリン酸エステルナトリウムおよびアスコルビン酸の含量は表示量の90%以上となり、脂肪粒子の粗大化による不溶性微粒子の増大は認められませんでした。1) エネフリード輸液 電子添文 2020年11月改訂(第2版)
2) エネフリード輸液 インタビューフォーム 2020年12月改訂(第2版) -
- ●医療機関で廃棄する場合
事業活動にて発生する廃棄物なので産業廃棄物として取り扱います。
廃棄方法の詳細は、産業廃棄物の回収業者にご確認ください。
●患者宅で廃棄する場合
容器はプラスチックとして、各自治体のルールに従い廃棄してください。
- ●医療機関で廃棄する場合
-
イノソリッド配合経腸用半固形剤には、食物繊維としてイヌリンを配合しました。
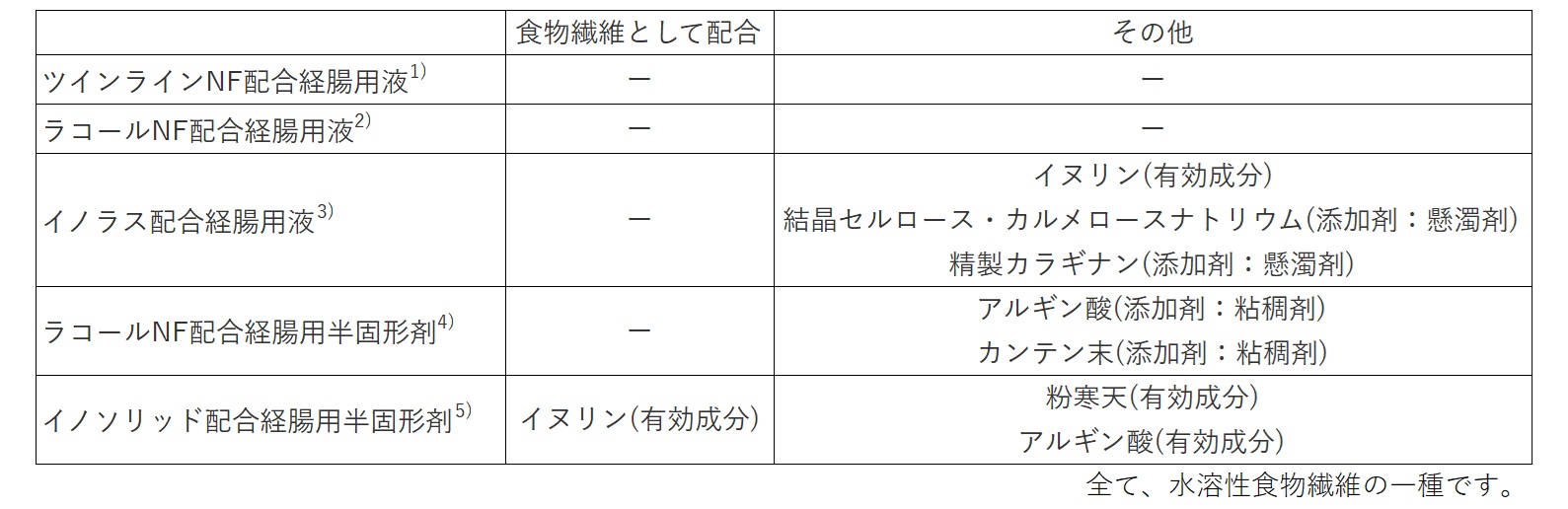
1) ツインラインNF配合経腸用液 電子添文 2022年4月改訂(第1版)
2) ラコールNF配合経腸用液 電子添文 2022年6月改訂(第1版)
3) イノラス配合経腸用液 電子添文 2023年5月改訂(第2版)
4) ラコールNF配合経腸用半固形剤 電子添文 2022年4月改訂(第1版)
5) イノソリッド配合経腸用半固形剤 電子添文 2024年11月改訂(第2版) -
以下、組成表をご確認ください。
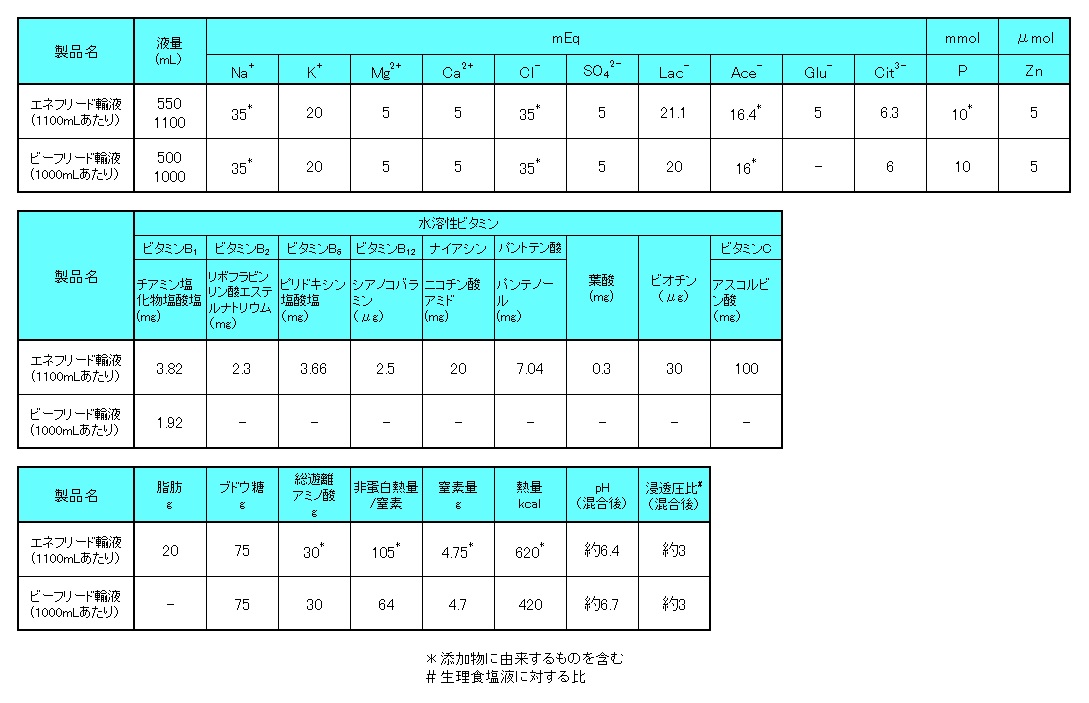
1) エネフリード輸液 電子添文 2020年11月改訂(第2版)
2) ビーフリード輸液 電子添文 2025年1月改訂(第2版) -
一般的な経腸栄養剤の下痢の原因と対策については、以下の通りです。
①投与速度:投与速度が速すぎることが下痢の原因で最も多い 1) 2)
・ポンプを使用して投与速度を低速・一定にします。
・20~30mL/時の24時間連続投与で開始し、1~2日ごとに投与速度を上げ、下痢をおこした場合は前の速度に戻してださい。
・投与速度の目安は、胃内投与で200mL/時間、空腸投与で100mL/時間以内です。
なお、投与速度は各製品の電子添文をご確認ください。②栄養剤の浸透圧:高浸透圧性の下痢 1) 2)
・半消化態栄養剤(300~400mOsm/L)の場合、投与速度を遅くすることで対応可能です。
・成分栄養剤や消化態栄養剤(550~760mOsm/L)の場合、より投与速度を遅くするか、0.5kcal/mLに希釈したもので開始し、便の性状を観察しながら2~3日ごとに濃度と投与速度を上げてください。③栄養剤の組成 1) 2)
・乳糖不耐症が疑われる場合には乳糖を含まない製品を選択 してください。
・食物繊維を投与する、食物繊維を含む栄養剤に変更してください。
・脂質エネルギー比率の低い製品や中鎖脂肪酸トリグリセリド(MCT)の含有率の高い製品に変更してください。④細菌汚染 1) 2) 3)
・1回の投与時間は8時間以内に留めてください。
・水は栄養剤と別途投与してください。
・栄養剤の継ぎ足しはしないでください。
・バッグタイプの栄養剤を使用してください。
・投与器具を清潔に保持してください。
中性洗剤で洗浄する → 次亜塩素酸ナトリウムによる消毒する → よく乾燥する。⑤温度:冷たい栄養剤は腸管を刺激して下痢を誘発する恐れがある 2) 3) 4)
・栄養剤を室温に戻してから投与してください。1) 経腸栄養のリスクマネジメント-下痢を中心とした対策方法の検討- (資材番号:9698)
2) 佐藤敦子:経腸栄養剤の種類と選択ーどのような時、どの経腸栄養剤を選択すべきかー(編集/井上善文・足立加子),フジメディカル出版 2005:105-109 【RA30505K01】
3) 田村佳奈美:エキスパートナース, 2006;22(13):13-14【RA30506Z02】
4) 編集/岡田 正:経腸栄養の手引き(改訂版),医薬ジャーナル社 1996:114-117【RA30596C02】 -
①ルアースリップタイプ
カテーテルや注射針に挿しこみのみで接続するため固定されませんが、外しやすいといったメリットがあります。また、ルアースリップタイプには、中口タイプと横口タイプがあります。●中口タイプ
シリンジ外筒の先端でカテーテル等を接続する部分が先端の中心にあり、容量が0.5~5mLのサイズでは中口が標準です。<該当製品>
生食注シリンジ「オーツカ」5mL
生食注シリンジ「オーツカ」10mL
ヘパリンNaロック用10単位/mLシリンジ「オーツカ」5mL
ヘパリンNaロック用10単位/mLシリンジ「オーツカ」10mL
ヘパリンNaロック用100単位/mLシリンジ「オーツカ」5mL
ヘパリンNaロック用100単位/mLシリンジ「オーツカ」10mL
●横口タイプ
シリンジ外筒の先端でカテーテル等を接続する部分が先端の端にあり、シリンジ内に入った気泡を体内に注入しないための構造です。容量の大きいシリンジは血管穿刺の際の角度がつけにくいため、横口にすることで穿刺しやすくしています。<該当製品>
生食注シリンジ「オーツカ」20mL
②ルアーロックタイプ
シリンジや注射針、カテーテル等にねじが切られており、接続部の固定ができます。シリンジポンプを用いて注射薬を持続注入するような場合や、抗がん剤など刺激の強い薬液を取り扱う際に、カテーテル等が筒先から外れないようにするために用いられます。

【参考】
Otsuka Information Vol.102 プレフィルドシリンジ製剤接続のポイント(プレフィルドシリンジ製剤の取扱いについて) -
可能です。
塩化ナトリウム「オーツカ」( 日局 塩化ナトリウム ) の効能効果には、経口の適応もあります1)ので、実際に処方されている内容に従って、調剤料や薬剤料を請求してください。※補足
薬価収載医薬品は、医薬品医療機器等法上の承認内容に従って、内用薬、注射薬、外用薬の3区分のいずれかに分類されています。しかし、適応が単一ではなく複数として認められているものがいくつかあります。塩化ナトリウムのように、外用薬としての適応だけでなく内用薬や注射薬としての適応がある場合や、生理食塩液のように注射薬としての適応だけでなく外用薬としての適応が認められている場合などもこれに該当することになります2)。1) 塩化ナトリウム「オーツカ」電子添文 2023年12月改訂(第1版)
2) 日本薬剤師会:調剤と情報,2000;6(13):1929-1931【ZZ30500Z24】 -
大塚生食注 ( 日本薬局方 生理食塩液 ) の効能又は効果には外用がありますので、吸入液の希釈に使用することは可能です。
しかし、大塚蒸留水 ( 日本薬局方 注射用水 ) の効能又は効果は注射のみであり、吸入液の希釈や加湿目的のように外用で使用することはできません。注1) 大塚生食注や大塚蒸留水には保存剤は含まれませんので、開封後は速やかにご使用ください。
注2) エビデンスに基づいた感染制御 ( 改訂第二版 第1集-基礎編 ) では「ネブライザー装置や加湿器には滅菌水を使用する。(AⅢ) 」との記載があります。 -
医療関係者向け情報サイト内、「配合変化・容器」ページに各製品の容器適合性一覧を掲載しています。
大塚生食注 2ポート/ 大塚糖液5% 2ポートおよびTN製品 バイアル適合性一覧
適合性一覧に載っていない製品については、下記の数値を参考にしてください。
なお、液剤や、電子添文上溶解液として注射用水の使用が指定されておりバイアル内が予め液状となる場合は、接続時に液漏れの注意が必要となるため、使用を推奨しておりません。
調製に際しては各薬剤の電子添文をご確認ください。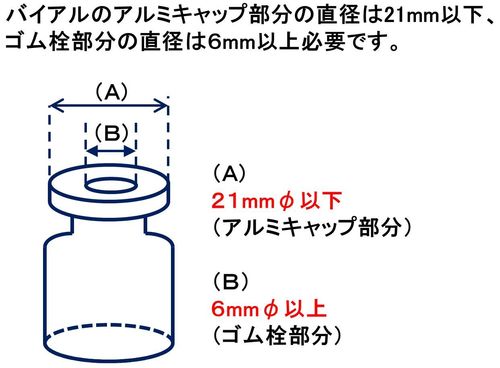
-
各製品の電子添文において、輸液では Na+ の mEq の値を 17.1 で割る、経腸栄養剤では Na の mg の値を 393.4 で割ると、食塩相当量 ( g ) が算出できます。
【例 1 】 ビーフリード輸液 500mL の場合
1 袋中の Na+ = 17.5 mEq → 17.5 ÷ 17.1 = 1.023 ≒ 約 1.0 g ( 食塩相当量 )【例 2 】 ラコールNF配合経腸用液 200mL の場合
1 袋中の Na = 147.6 mg → 147.6 ÷ 393.4 = 0.375 ≒ 約 0.38 g ( 食塩相当量 )【解説】
一般的に、医薬品に含まれるナトリウム ( Na ) は、経腸栄養剤では ( mg ) で、輸液ではNa+ ( ナトリウムイオン ) として ( mEq ) で表されています。食塩 ( 塩化ナトリウム、NaCl : 分子量 58.44 ) 1 g に含まれる量
Na+ は 17.1 mEq ( 1 / 58.44 × 1000 ≒ 17.1 )
Na ( 原子量 22.99 ) は 393.4 mg ( 1 / 58.44 × 22.99 × 1000 ≒ 393.4 )従って、製品電子添文の Na の mEq の値を 17.1 で割る、または mg の値を 393.4 で割ると、食塩相当量 ( g ) が計算できます。
-
バイアル接続時には、プラボトルの首部を持って傾け、バイアルのゴム栓の中央部を、注入針に対し垂直に完全に刺し込んでください1)。
バイアル接続時に胴体を握ってしまうと、容器内の空気が抜け、空間部が少なくなり、点滴速度が遅くなったり、残液が生じる原因となります2)。
また、バイアルのアルミキャップ部分に穿刺すると注入針が曲がったり、バイアルのゴム栓周辺部に穿刺するとバイアルのゴム栓が瓶内に落ち込んだりし、溶解操作ができなくなることがあります3)のでご注意ください。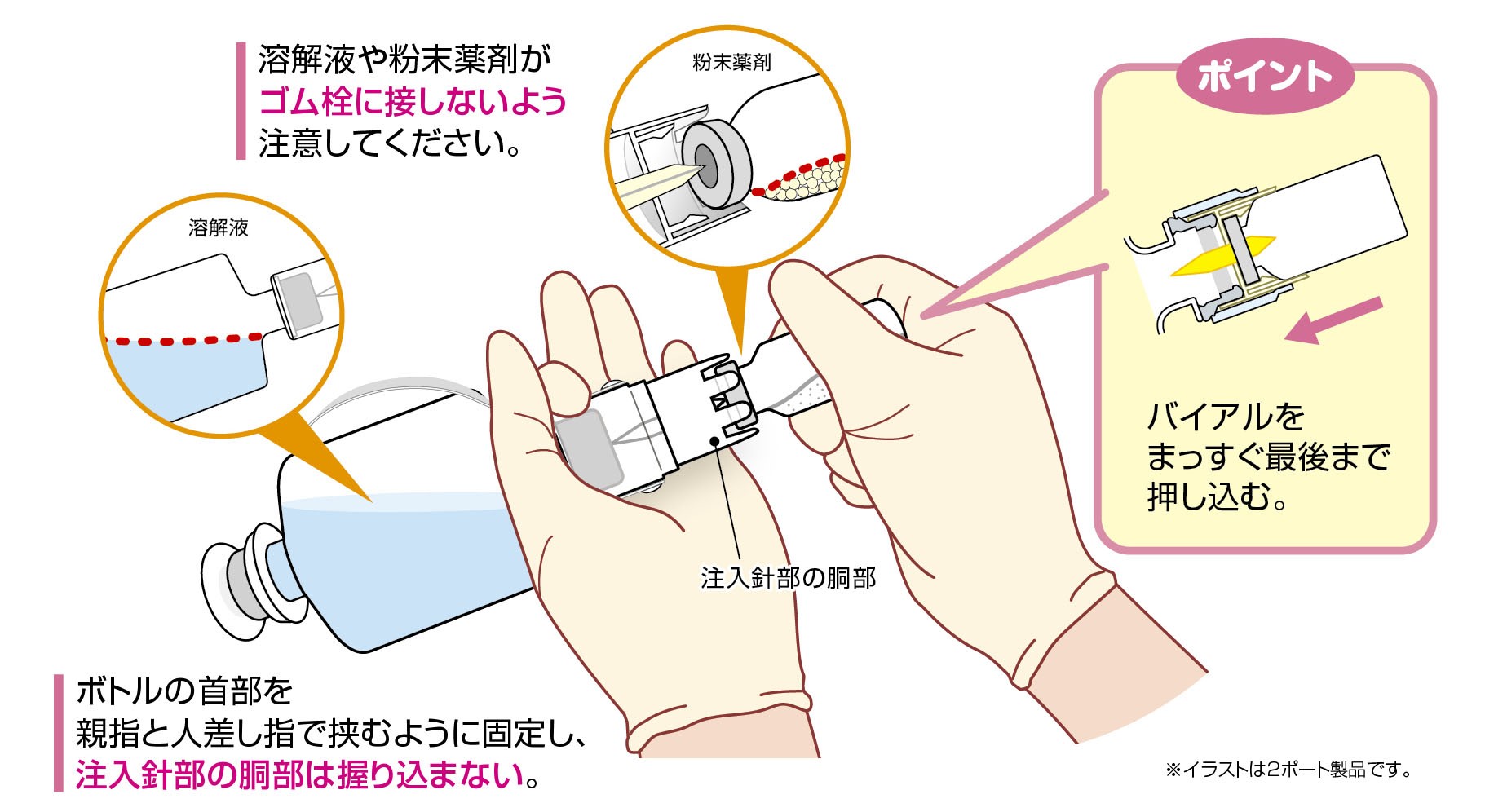
1) Otsuka Information Vol.123 バイアル接続時のポイント
2) Otsuka Information Vol.76 投与中に滴下が止まってしまうことはありませんか?
3) Otsuka Information Vol.113 注射針付溶解剤 注入針の曲がりの原因
4) Otsuka Information Vol.121 大塚生食注2ポート50mL・100mL、大塚糖液5%2ポート50mL・100mL 溶解操作方法 -
針刺し時の角度や針を回転させながら刺すなど手技にバラツキがあるため、何回まで針刺しが可能かという耐久性試験は行っていません。
針刺し回数が多くなると、コアリングや液漏れの原因になりますので、同一箇所への複数回穿刺を避けて、ゴム栓面に垂直 かつ ゆっくりと針を刺してください。
【ゴム栓への針刺しに関するトラブル例】
①ゴム栓からの液漏れについて
Otsuka Information Vo.68 ゴム栓からの液もれについて②針刺し時のコアリングについて
Otsuka Informartion Vo.2 針刺し時のコアリングについて【参考】
Otsuka Information Vo.94 混注針およびびん針は、針をゴム栓の指定位置(○印)に、まっすぐゆっくりと刺してください
Otsuka Information Vol.85 輸液セットのびん針を刺したときに液もれが起こる例 -
イントラリポス輸液は、末梢静脈ルートまたは中心静脈ルートから、原則単独投与してください。
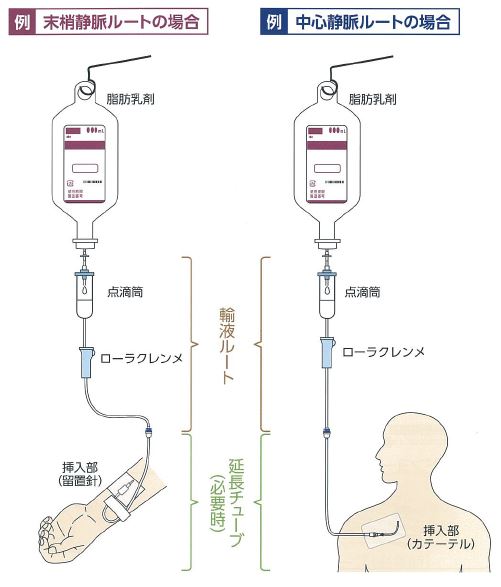
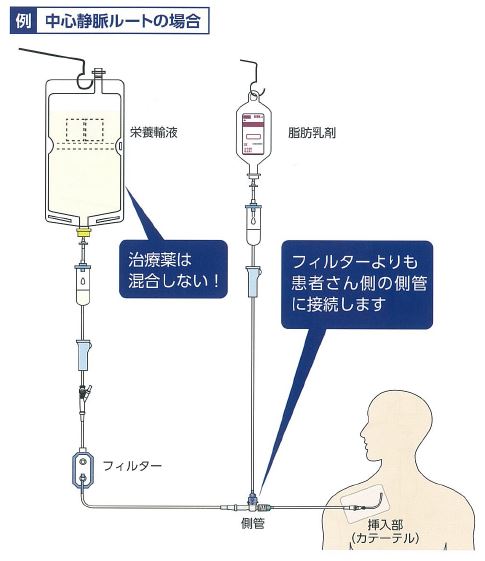
中心静脈ルートで、どうしても別ルートがとれず、かつ高カロリー輸液をとめることができない場合には、フィルターより患者様側の側管から投与することがあります。
但しその場合、高カロリー輸液に他の治療薬などが混注されていないことが前提となります。
また、脂肪粒子は0.2μmのフィルターを通過しないため、中心静脈栄養の側管投与の場合はフィルターよりも患者側の側管に接続するようご注意ください。【同時投与】
【参考】 脂肪乳剤関連情報
-
開封後の安定性データは確認しておりません。
大塚生食注(日局 生理食塩液)や大塚蒸留水(日局 注射用水)には、保存剤が配合されておらず、 開封後は異物の混入や菌増殖のリスクがあるため、保存はお勧めできません。
電子添文に「残液は使用しないこと」と記載しております通り、速やかにご使用ください。
1) 大塚生食注 電子添文 2023年5月改訂(第1版)
2) 大塚蒸留水 電子添文 2023年9月改訂(第1版) -
ISO 80369-3 タイプは、旧規格と接続の向き(オスメス(凸凹)) が変更になっています。

経腸栄養製品の国際規格(ISO 80369-3)対応に伴い、経腸用半固形剤専用アダプタ、ラコールNF配合経腸用半固形剤専用アダプタ、半固形剤吸引用コネクタの ISO 80369-3 タイプを販売しております。引き続き、旧規格も継続供給いたします。
ISO 80369-3 タイプの製品は、旧規格と接続できません。
経腸用半固形剤専用アダプタ(ISO 80369-3 タイプ)とラコールNF配合経腸用半固形剤専用アダプタ(ISO 80369-3 タイプ)は、ISO 80369-3 タイプのチューブと接続してください。
半固形剤吸引用コネクタ(ISO 80369-3 タイプ)は、ISO 80369-3 タイプのシリンジと接続してください。
ラコールNF配合経腸用液(400mLバッグ)のノズルは変更ありません。
【参考】
コネクタの誤接続による医療事故事例が国内外で報告されており、これまで経腸栄養ラインと輸液ラインが物理的に接続できないよう基準を改正する等の対応がなされてきました。近年、ベッドサイドで起こりうるコネクタの誤接続を防止するため、経腸栄養分野においても、誤接続防止による医療安全の向上や国際整合による製品の安定供給確保の観点から、国際規格の導入が検討されてきました。数年にわたる検討が続けられた結果、「相互接続防止コネクタに係る国際規格(ISO(IEC)80369シリーズ)の導入について」1)が発出され、誤接続防止コネクタの国内導入が決定されました。1)平成29年10月4日付け 医政総発1004第1号、薬生薬審発1004第1号、薬生機審発1004第1号、薬生安発1004第1号通知
-
ヘパリンNaロック用は、濃度によってルート内の血液凝固を防止できる時間が違います。
ヘパリンNaロック用10単位/mLシリンジ「オーツカ」5mL、ヘパリンNaロック用10単位/mLシリンジ「オーツカ」10mLは 6時間までの短時間のロックが必要な場合、ヘパリンNaロック用100単位/mLシリンジ「オーツカ」5mL、ヘパリンNaロック用100単位/mLシリンジ「オーツカ」10mLは 12~24 時間の長時間のロックが必要な場合に用います1)。【参考】
・中心静脈カテーテルは閉塞を起こすとルートの交換が大変なので、ロックの時間にかかわらず 100単位/mL を使用するほうが望ましいとの報告もあります2)3)。6. 用法及び用量1)
静脈内留置ルート内を充てんするのに十分な量を注入する。
7. 用法及び用量に関連する注意1)
10単位/mL製剤は通常 6時間までの、100単位/mL製剤は 12時間までを標準とし最長 24時間までの静脈内留置ルート内の血液凝固防止 ( ヘパリンロック ) に用いる。1) ヘパリンNaロック用10単位/mLシリンジ「オーツカ」5mL・10mL、ヘパリンNaロック用100単位/mLシリンジ「オーツカ」5mL・10mL 電子添文 2024年7月改訂(第3版)
2) 白石静江:ヘパリンロックと生食ロック/その考え方と方法,看護技術,49(10),876,2003 【IV30503I01】
3) 井上善文:ヘパリンロックと輸液管理,感染と消毒,10(2),125,2003【PS30503B01】 -
加温する際は、注入器を接続する前に、未開封のまま湯煎 ( 40 ℃ 以下 ) にて短時間で行ってください。高温で湯煎すると性状に変化が認められます1)2)。
湯煎(40℃以下)にて10分程度で人肌程度に温まります3)4)。
電子レンジで直接加温すると容器の破損が懸念されますのでお控えください。
1) イノソリッド配合経腸用半固形 電子添文 2024年11月改訂(第2版)
2) ラコールNF配合経腸用半固形剤 電子添文 2022年4月改訂(第1版)
3) イノソリッド配合経腸用半固形 インタビューフォーム 2024年11月改訂(第2版)
4) ラコールNF配合経腸用半固形剤インタビューフォーム 2022年10月改訂(第6版) -
輸液の加温は 42 ℃ までに留めておくのが望ましいと言われます。
誤って 42 ℃ 以上の輸液を投与した場合には、溶血による副作用が懸念されます 1)。輸液製品を温める方法として、温湯、恒温器、電子レンジ等の使用が考えられますが、電子レンジでの加温は、使用するレンジによって加温状況にばらつきがでることや破袋などのおそれがあります。
なお、繰り返しの加温は避けてください。
1) 塩崎忠彦:救急医学,2006;30(3):357-360【ZA30506C03】
-
ラコールNF配合経腸用液を初めて使用する場合や、投与速度を調整しても腹部症状が改善しない場合は濃度を調整してください。
投与開始時は、通常1日当たり 400mL (400kcal) を水で希釈 (0.5kcal/mL程度) して、低速度 (約100mL/時間以下) で投与し、臨床症状に注意しながら増量して3~7日で標準量に達するようにしてください 1)。【注意】
希釈する場合は、微生物汚染防止の観点から、白湯*) 等をご使用ください。
*) 白湯 (さゆ) : 沸騰させた水を冷ました物1) ラコールNF配合経腸用液 電子添文 2022年6月改訂(第1版)
-
主な製品の配合変化表(データは24時間まで)は、医療関係者向け情報サイト内、「配合変化・容器」ページに掲載しています。
注意事項
ここに提供する配合変化データは、限られた条件下で試験を実施した参考情報であり、薬剤の配合を推奨するものではありません。配合変化表に試験結果が無いものは、配合薬の電子添文に「配合不可」と受け取れる記載がある可能性があります。本配合変化表ご利用の前に、配合薬の電子添文をご確認ください。
- 経時変化の欄は、配合後のpHと外観観察の結果のみを記載しています。配合薬の含量(力価)は測定していないため、配合の可否や調製条件の的確性を保証するものではありません。
- 輸液と配合薬の組み合わせが同じでも、弊社の試験条件(調製方法、保存状況等)と異なる条件で配合した場合、結果が異なることがあります。このことから、配合薬メーカーが提供する配合変化試験の結果と一致しない場合があります。
- 弊社輸液製品の電子添文上、併用禁忌薬剤はありませんが、ネオパレン輸液、キドパレン輸液およびエルネオパNF輸液の電子添文には併用注意薬剤として「パーキンソン病治療薬(レボドパ)、ワルファリン、ジギタリス製剤(ジゴキシン等)」があります。また、ネオファーゲン静注20mLの電子添文には併用注意薬剤として「ループ利尿剤、チアジド系及びその類似降圧利尿剤(トリクロルメチアジドクロルタリドン等)、モキシフロキサシン塩酸塩」があります。
- 配合後に外観変化があるものは、「配合変化を起こす組み合わせである」ことを考慮し、薬剤配合後の経過時間に関わらず、配合はお勧めしません。
配合変化表に記載しない薬剤および組み合わせについて
- 皮下注、筋注製剤のような「静注が用法外」となる薬剤
- カルシウム含有輸液とロセフィン静注用との組み合わせ(ロセフィン静注用の電子添文に、国外においてセフトリアキソンを成分とする結晶により死亡に至った症例が報告されているため)
- 薬剤配合後のカリウムイオン濃度が40mEq/Lを超える組み合わせ(カリウム製剤の電子添文には、カリウムイオン濃度として40mEq/L以下に希釈して使用する旨の記載があるため)
- 電子添文に「配合不可」と判断できる記載がある薬剤とそれに該当する輸液との組み合わせ(記載例:~と配合しないこと、~との配合を避けること、~と混合又は希釈して使用しないこと、~と同一経路からの点滴はしないこと等)
配合薬の記載内容について
- 配合薬名、販売会社名は保険薬事典に基づき記載しておりますが、いずれも試験実施時から変更となっている場合があります。
- 配合薬のpH・色調については、試験実施時の電子添文を参考に記載しているため、現在の電子添文情報と異なる場合があります。配合薬剤の最新の電子添文をご確認ください。
-
輸液投与中にルート内が白濁する原因としては、下記のようなものが考えられます。
なお、ルートやバッグ内が白濁しているのを確認した場合、直ちに投与を中止してください。追加投与の必要があれば新しい輸液と輸液セットに取り替えてください。①バッグ内に混注した薬剤や側管から投与した薬剤による配合変化 1)
薬剤を混注したり側管投与する際には、電子添文、インタビューフォーム、各社の配合変化表などを確認してください。②微生物汚染 (真菌、細菌など) 2)
ルート内に侵入した微生物が増殖して白濁して見えることがあります。
輸液の調製・投与時には衛生操作に留意してください。容器ゴム栓と輸液セットの接続部や輸液ラインの接続部・側注口などの汚染防止と確実な消毒をお願いします。1) Otsuka Infomation Vol.73 薬剤を側管から投与する場合・・・
2) Otsuka Infomation Vol.99 輸液管理時の清潔操作 微生物の侵入にご注意ください -
アミノレバン点滴静注、キドミン輸液、KN3号輸液において、セフトリアキソンナトリウムとの配合変化情報があります。「配合変化・容器」ページに掲載している配合変化表をご参照ください。
ただし、セフトリアキソンナトリウムは、カルシウム含有製剤と同時投与を行ってはならないとの注意喚起がなされている注射剤です。
したがいましてカルシウムを含有する輸液製剤との配合変化試験は行っていません。
【参考】注射用セフトリアキソンナトリウムの電子添文
8. 重要な基本的注意
8.3 本剤を投与する場合は、カルシウムを含有する注射剤又は輸液と同時に投与しないこと。国外において、新生児に本剤とカルシウムを含有する注射剤又は輸液を同一経路から同時に投与した場合に、肺、腎臓等に生じたセフトリアキソンを成分とする結晶により、死亡に至った症例が報告されている。14. 適用上の注意
14.1 薬剤調製時の注意
14.1.2 配合変化
(2) カルシウムを含有する注射剤又は輸液との配合により混濁等の変化が認められたとの報告があるので、配合しないこと。
-
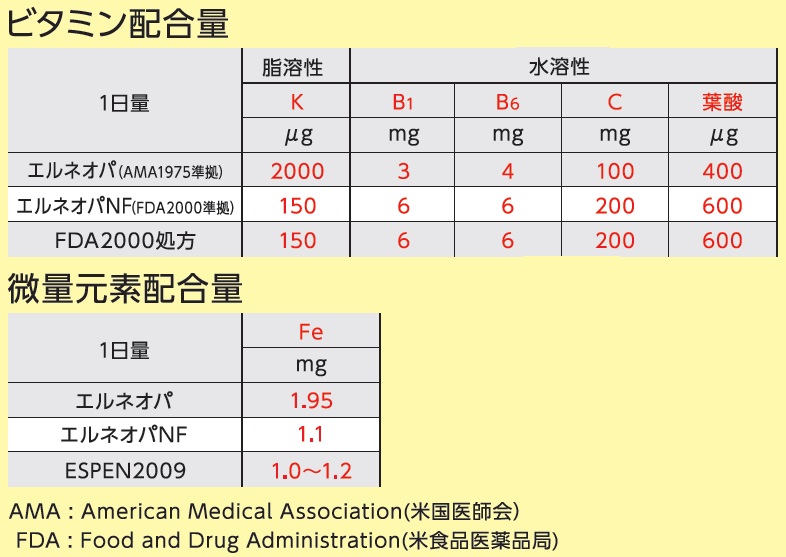
NF = New Formula = 新しい組成・処方という意味です。
エルネオパNF輸液は、一部のビタミンと微量元素の組成を海外で広く使用実績のある処方を参考に改良しました。
◆ ビタミン (FDA2000処方に準拠※1)
チアミン塩化物塩酸塩 (VB 1)、アスコルビン酸(VC)はエルネオパ(終売)と比較して 2 倍増量し、ピリドキシン塩酸塩 (VB 6) と葉酸は 1.5 倍増量、フィトナジオン (VK) は 約1/13 に減量している。
併用注意 : ピリドキシン塩酸塩はレボドパの有効性を減じるおそれがあり、フィトナジオンはワルファリンの作用を減弱することがあります。
※1 Federal Register. April 20, 2000;65(77). 21200-21201
◆ 微量元素 (ESPENガイドライン※2鉄 (Fe) を約 1/2 に減量している。
※2 ESPEN guidelines on parenteral nutrition : Surgery. Clin. Nutr., 2009.
【参考】新旧製品におけるビタミンと微量元素組成の比較 (相違点のみ)
-
開封後は、微生物汚染及び直射日光を避け、できるだけ早めに使い切ってください。やむを得ず冷蔵庫内に保存する場合には、24時間以内に使い切ってください。1)
(注意) 菌汚染について検討しておりませんので、一度口をつけた残液は廃棄してください。
1)イノラス配合経腸用液 電子添文 2023年5月改訂(第2版)
-
電子添文通り、10%製剤は 500 mL を 3時間以上かけて、20%製剤は 250 mL を3時間以上かけて、20% 100 mL製剤は、72分以上かけて投与します。この速度より速く投与すると、発熱・悪心等の副作用が増えたという報告があります 1) 。
なお、近年の代謝研究から、脂肪として 0.1g/kg/hr 以下の速度で投与するのが望ましいとの意見もあります。この投与速度は、入山らの報告に基づくもので、正常血清脂質値の被験者3例に対し 0.5g/kg/hr の投与速度で脂質を30分間投与し、血中トリグリセライド値を 500mg/dL に設定しました。その後、投与速度を0.1あるいは 0.3g/kg/hr に変更したという試験を行っています(表1)。その結果、脂肪乳剤の投与速度が 0.3g/kg/hr では血中トリグリセリド値の上昇を認めましたが、0.1g/kg/hr の投与速度では血中トリグリセリド値の上昇は認めませんでした。このことから 0.1g/kg/hr 以下がより適切であるとしています 2) 3) 。
図1 2種類の投与速度における血中TG値 2)
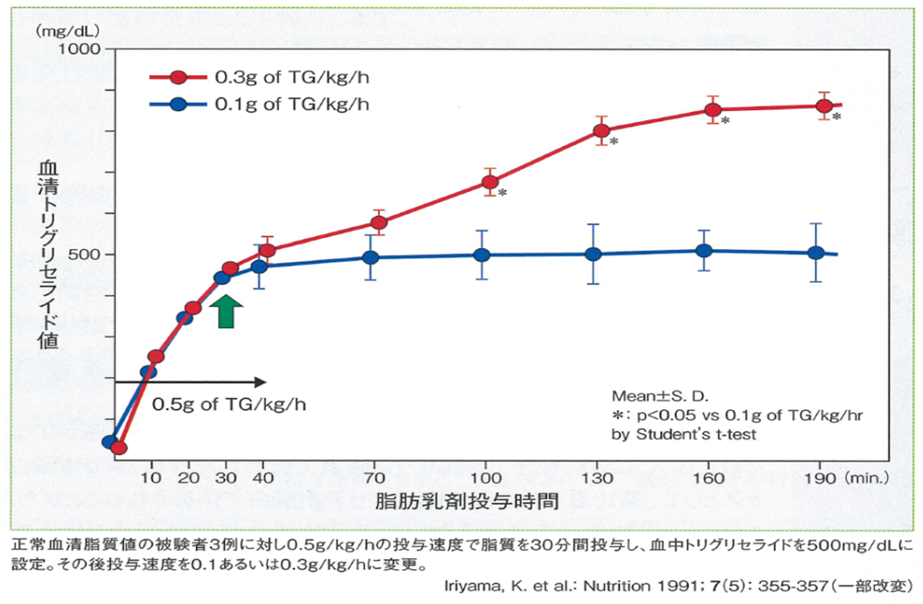
1) 昭和52年10月28日 薬発第1226号(第一次再評価結果その13)
2) 編集/日本静脈経腸栄養学会:静脈経腸栄養ガイドライン-第3版-,照林社2013:p41
3) lriyama,K.et al.:Nutrition 1991;1991;7(5):355-357【MX30591E01】 -
電解質はそれぞれ最大投与速度が決められています。
最大投与速度
水分・電解質 Na+ 100 mEq/hr HCO3- 100 mEq/hr 10 mEq/min K+ 20 mEq/hr Ca2+ 20 mEq/hr 1 mEq/min Mg2+ 20 mEq/hr 1 mEq/min リン 20 mEq/hr NH4 20 mEq/hr 河野克彬:輸液療法入門 改訂2版 金芳堂 1995:p306より作成
-
ビーフリード輸液を急速投与すると、ブドウ糖による高血糖、アミノ酸による悪心・嘔吐などを引き起こすおそれがあります。また、投与終了後の低血糖も危惧されます。
電子添文の投与速度は、ブドウ糖・アミノ酸の最大投与速度をもとに設定し、臨床試験において安全に投与できることを確認して決定しました。
【参考】
ブドウ糖の最大投与速度 : 0.5g/kg/時 ( 昭和52年10月28日 薬発第1226号第一次再評価結果その13 )
アミノ酸の最大投与速度 : 0.2g/kg/時1)1) 河野克彬:忘れてはならない注意事項,輸液療法入門,304,1989【ZA30589Z18】
-
各種製剤の電子添文の記載内容に従い開封後・開通後は速やかにご使用ください。
①脂肪を含まない輸液
本邦には脂肪を含まない輸液の投与時間に関するガイドラインの勧告がありません。参考として、ブドウ糖加アミノ酸製剤にセラチア菌を接種し、24時間室温下では、セラチア菌の増殖を認めたという報告 1) や、薬液の汚染を予防する上で投与する輸液は1日1回以上の交換を推奨している報告もあります 2) 。従って、点滴静注開始後は速やかな投与をお願いします。
②脂肪を含む輸液
2002年版 血管内留置カテーテル由来感染の予防のためのCDCガイドラインでは、12~24時間以内の投与が推奨されていました。
(※2011年版 CDCガイドラインでは輸液を懸垂してからの交換頻度に関する記載は削除されています。)表1 推奨投与時間 資料名 推奨時間 血管内カテーテル由来感染予防のための
CDCガイドライン(2002年版)脂肪を含む輸液
24時間以内脂肪乳剤単独
12時間以内
(カテゴリーⅠB)1) 岩谷昭,他:新潟医学会雑誌,2003;117(9):469-478【ZA30503I01】
2) 編集/五関謹秀:ナースに必要な輸液の知識,へるす出版1999:186-197【ZA30599Z17】 -
ビーフリード輸液の皮下投与は用法外使用です。
皮下投与の用法がある輸液は、キット製剤を除く大塚生食注 ( 日局 生理食塩液 ) のみです。ビーフリード輸液は、浸透圧比約3の高張輸液です。
等張液以外の皮下投与は、疼痛や発赤などの副作用をきたすおそれがあります。また、皮下輸液では十分な栄養補給は困難であるとされています 1)。1) 緩和医療ガイドライン委員会:終末期がん患者の輸液療法に関するガイドライン2013年版 ( 編集 特定非営利活動法人 日本緩和医療学会 緩和医療ガイドライン作成委員会 ) ,金原出版 2013:p41-43【ZA30513A03】
-
高カロリー輸液投与時に併用する総合ビタミン剤には、界面活性作用を有する成分が含まれています。この界面活性成分により輸液の表面張力が低下し、1滴の大きさ (滴容量) が小さくなります。そのために、時間あたりの滴下数が同じ場合でも実際の投与量が少なくなるため、予定時間に終了しないことがあります。
従って、投与速度の設定は、滴容量に応じて滴下数を調節してください。また、時間あたりの滴下数で流量を制御する輸液ポンプでは、滴容量に応じた補正が必要です。
※実際の補正 (変化率) については下記のOtsuka Informationをご覧ください。
-
輸液内へ注射剤を混合すると希釈されるために、比較的配合変化が起こりにくいですが、側管から注入する場合、高濃度で薬剤が注入されるため、ルート内で配合変化が起こりやすくなります。
配合変化を回避するためにも、薬剤の投与前後にフラッシングをお勧めします。
1) Otsuka Information Vol.73 薬剤を側管から投与する場合・・・
2) 配合変化表 ご利用上の注意 -
精製水は、イオン交換、蒸留、逆浸透又は限外ろ過などを単独あるいは組み合わせたシステムにより「常水」から製したものです。 「精製水」は薬品の溶剤として製剤、試液・試薬の調製、器具の洗浄に用いますが、注射液、点眼液の調製に用いることはできません。
滅菌精製水は、「精製水」を滅菌して製したものです。「滅菌精製水」は溶解剤として無菌を条件とする製剤の調製、医療器具の洗浄に用いますが、注射剤の調製に用いることはできません。
注射用水 は「常水」にイオン交換、逆浸透等による適切な前処理を行った水又は「精製水」の蒸留又は超ろ過により製した水です。エンドトキシンは0.25EU/mL未満とされています。
なお、「注射用水(容器入り)」を蒸留法により製造した場合は「注射用蒸留水」と表示することができます。1) 第十八改正日本薬局方解説書, 廣川書店:C-2507~2515
-
【細口開栓】
キャップを外し、四角い羽状のつまみひねって開栓すると、直径6mmの穴が開きます。【広口開栓】
キャップを外し、キャップリングに指をかけ引っ張って開栓すると、500mLは直径19mm、1000mLは直径27mmの穴が開きます。* 開栓方法、開口部径、ボトルの形状は、大塚生食注 (日局 生理食塩液) と大塚蒸留水 (日局 注射用水) ともに同じです。
開栓方法
広口開栓の開栓時の注意
●Otsuka Infomation Vol.97 プラボトル製品 ゴム栓部のキャップの開封方法開栓タイプの形状
-
成人の一日の必要水分量は、一般的に 2000~2500mLです 1)。
本剤2000mL投与によって、短期間経口摂取不能な場合に、成人1日に必要なアミノ酸、電解質、水分を補給できるよう配慮しています。
以上より、先行製品であるアミノフリード輸液(終売)の臨床第Ⅲ相一般試験の1日最大投与量を2500mLまでとして実施したことから 2)、このような設定となりました。
なお、ビーフリード輸液の用法及び用量はアミノフリード輸液(終売)に準じています。1) 小野寺時夫:Medical Practice,1990;7:96-100【ZA30590Z12】
2) 大柳治正:薬理と治療,1994;22(4):949-968【AF10594C05】 -
輸液中に含まれるチアミン ( ビタミンB 1 ) は、長時間にわたって光にさらされると分解することが知られています。ビーフリード輸液では、その原因となる紫外線 ( UV ) をカットする外袋を使用しています。透明な外袋ですが、UVカット機能があります。
-
イノソリッド配合経腸用半固形剤およびラコールNF配合経腸用半固形剤の投与方法は、大きくは2種類あります。
1) 経腸用半固形剤専用アダプタまたはラコールNF配合経腸用半固形剤専用アダプタを用いる方法
2) カテーテルチップシリンジを用いる方法【新規格:ISO80369-3タイプ】
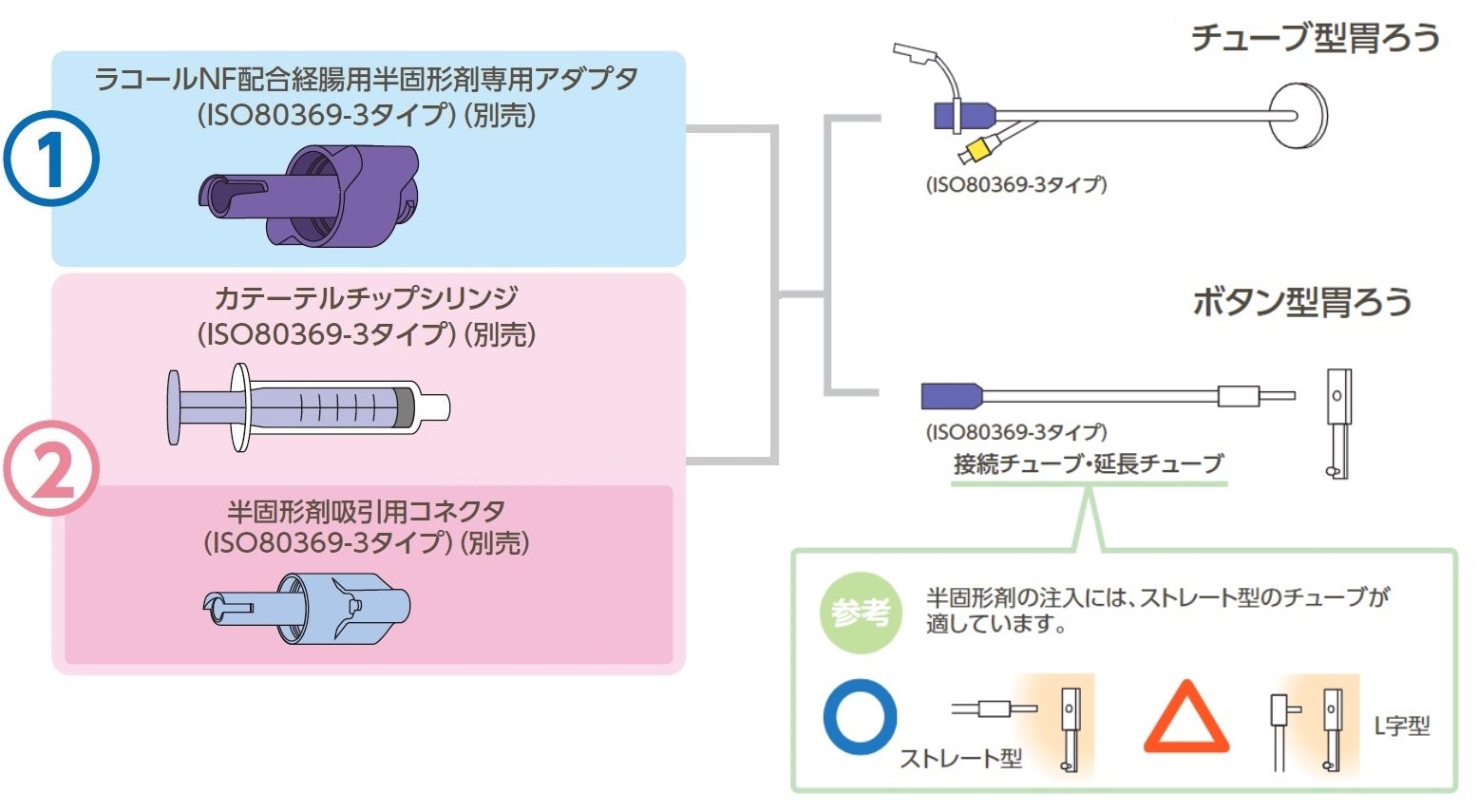
各注入方法については、以下のPDFおよび動画などをご覧ください。
①経腸用半固形剤専用アダプタ・ラコールNF配合経腸用半固形剤専用アダプタ(別売り)
●ISO80369-3対応半固形剤専用アダプタと加圧バッグを用いた注入方法(動画)
●ISO80369-3対応経腸用半固形剤専用アダプタを用いた投与の手順(PDF)
●はじめての半固形剤注入法の手びき(ISO80369-3対応)②カテーテルチップシリンジ(別売り)
●ISO対応半固形剤吸引用コネクタ、カテーテルチップシリンジを用いた注入方法(動画)
●ISO対応カテーテルチップシリンジを用いた注入方法(動画)
●ISO対応半固形剤吸引用コネクタ、カテーテルチップシリンジを用いた投与の手順(PDF)
●はじめての半固形剤注入法の手びき(ISO80369-3対応)
【旧規格】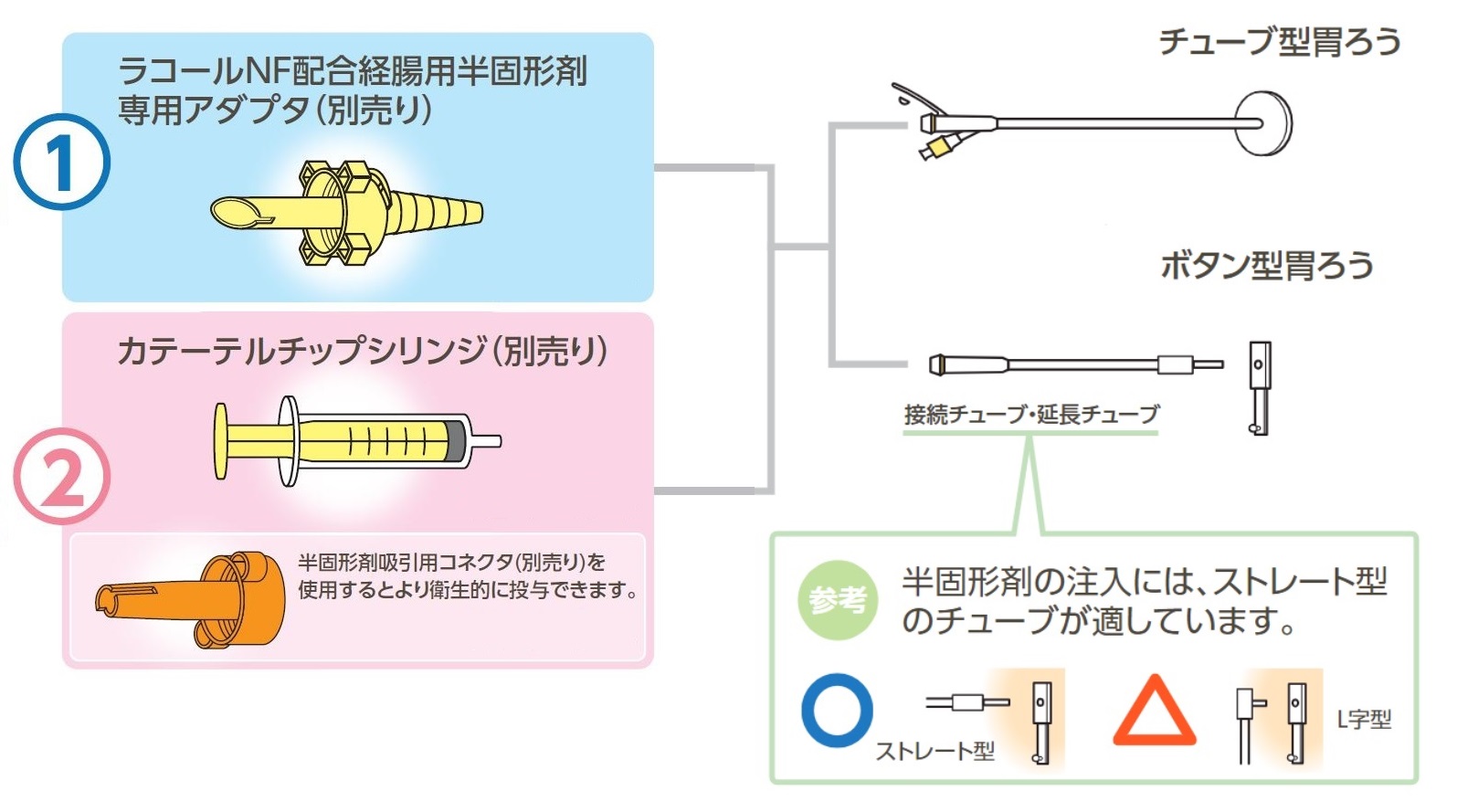
各注入方法については、以下のPDFおよび動画等をご覧ください。
①経腸用半固形剤専用アダプタ・ラコールNF配合経腸用半固形剤専用アダプタ (別売り)
●アダプタおよび加圧バッグを用いた注入方法(動画)
●経腸用半固形剤専用アダプタを用いた投与の手順(PDF)
●はじめての半固形剤注入法の手びき(旧規格対応)②カテーテルチップシリンジ (別売り)
●半固形剤吸引用コネクタ、カテーテルチップシリンジを用いた注入方法(動画)
●カテーテルチップシリンジを用いた注入方法(動画)
●半固形剤吸引用コネクタ、カテーテルチップシリンジを用いた投与の手順(PDF)
●はじめての半固形剤注入法の手びき(旧規格対応)【お知らせ】
新規格製品(ISO 80369-3タイプ)と旧規格製品のコネクタは太さや形状が異なるため、両製品を相互に接続することはできません。【警告】
経腸用半固形剤専用アダプタ(旧規格)電子添文2024年10月作成(第1版)およびラコールNF配合経腸用半固形剤専用アダプタ(旧規格) 電子添文 2024年10月改訂(第3版)より抜粋
〈使用方法〉
本品は、ISO 80369-3 に適合した製品(新規格製品)の使用が困難であると医師が判断した場合に、以下の1.~4.に全て対応したうえで使用すること。[他領域のコネクタとの誤接続等の不慮のリスクがある。]1. 旧規格製品を使用することについて、その目的に見合った医学的理由があると医師が判断すること。
2. 本品における誤接続のリスクや例外的な使用をすることに伴う不利益(例:緊急入院先で新規格製品が導入されている場合)を被る可能性があることを1.とともに医師が患者に説明した上で、その使用について患者の同意を得ること。
3. 本品を使用することについて、医療従事者等の本品の使用に携わる関係者で情報共有し、十分なモニタリング体制を敷くこと。
4. 1.~3.に関する記録を行うこと。 -
プラスチック容器の表面に油性ペンで文字などを書いた場合、それに含まれるキシレンなどの溶剤がプラスチックを透過して容器内に移行することがあります。
使用するペンや、インクの量(文字数など)によって溶剤の透過量は異なります。油性ペンで直接記入する際には必要最小限にとどめるか、ラベルなどのご使用をお奨めします。
-
電子添文において、注射用水や5%ブドウ糖液で希釈する、との記載があります。
メイロン静注 (日局 炭酸水素ナトリウム注射液) はもともと ナトリウム ( Na ) 濃度が高い製品であり、Na の過剰投与が危惧されますので、生理食塩液での希釈はお勧めしかねます。
製品名 電解質濃度 mEq/L Na+ HCO3- メイロン静注7% 833 833 メイロン静注8.4% 1000 1000 9.7 小児等への投与1)2)
9.7.1 新生児
必要最少量を注射用水で2%以下の濃度に希釈して、できるだけ緩徐(1mEq/分以下)に投与することが望ましい。高濃度液を投与すると、頭蓋内出血を起こすとの報告がある。14.3 薬剤投与時の注意1)2)
14.3.4(抜粋) 細い静脈しか得られないときは、適量の注射用水や5%ブドウ糖注射液で希釈し、緩徐に静脈内注射(点滴)すること。1) メイロン静注7% 電子添文 2023年8月改訂(第1版)
2) メイロン静注8.4% 電子添文 2023年8月改訂(第1版) -
菱形マークは、周囲にある3つの穿刺位置(○印)を識別するための目印です。
同じ○印の中に何度も針刺しを行うと、コアリングや液漏れが発生しやすくなりますので、針を刺した箇所を識別しやすくするために、穿刺位置の1つに菱形マークをつけています。【例】ゴム栓の例
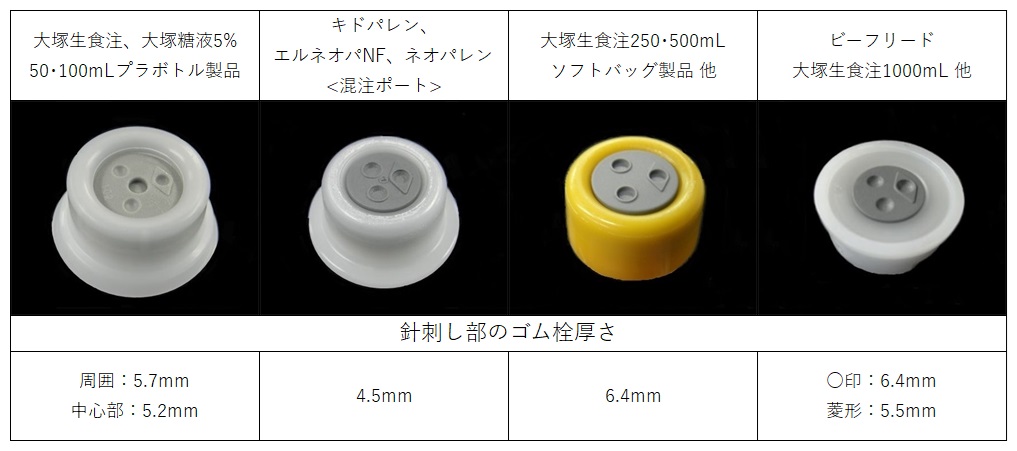
-
カリウムは心機能への影響が大きく、急激なカリウム補正 (血清K値の上昇) は、心停止を起こすおそれがあるので、慎重に投与する必要があります。
【カリウムの投与基準】1)
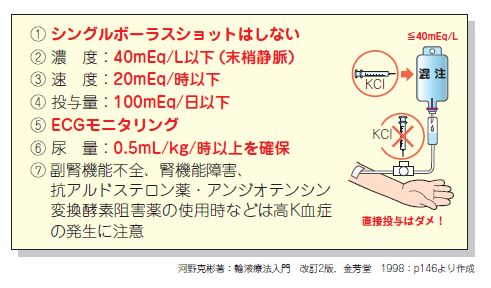
1) 河野克彬 : 輸液療法入門 改訂2版 , 金芳堂. 1988 . p146-151 【ZA30595Z18】
-
溶血が起こりますので、単独投与はしないでください。
注射用水は浸透圧物質含まない極端な低張液ですので、単独で静脈内に投与してしまった場合、赤血球の破壊 (溶血) が起こり、その結果、血中にヘモグロビンが放出されます。 溶血の程度にもよりますが、下記のような症状が現れます。
1) 赤血球減少による貧血 (溶血性貧血)
2) ピンク~赤褐色~暗赤色のヘモグロビン尿
3) 重篤な場合には急性腎障害などの症状
4) LDH、AST上昇
5) 間接ビリルビンの上昇などの検査値変動なお、 大塚蒸留水 (日局 注射用水) の電子添文 【用法・用量】には、「本品の適当量をとり、注射剤の溶解、希釈に用いる。また、注射剤の製剤に用いる。」と記載されており、大塚蒸留水のみを点滴することは適応外使用にあたります。 また、ゴム栓タイプの大塚蒸留水のラベルには、「単独点滴禁止」との注意事項を記載しています。
【参考】
松田 晃(監修) : 溶血性貧血 , 病気がみえる Vol.5 血液 , メディックメディア社 2008 : p36-37 【ZA30508K01】 -
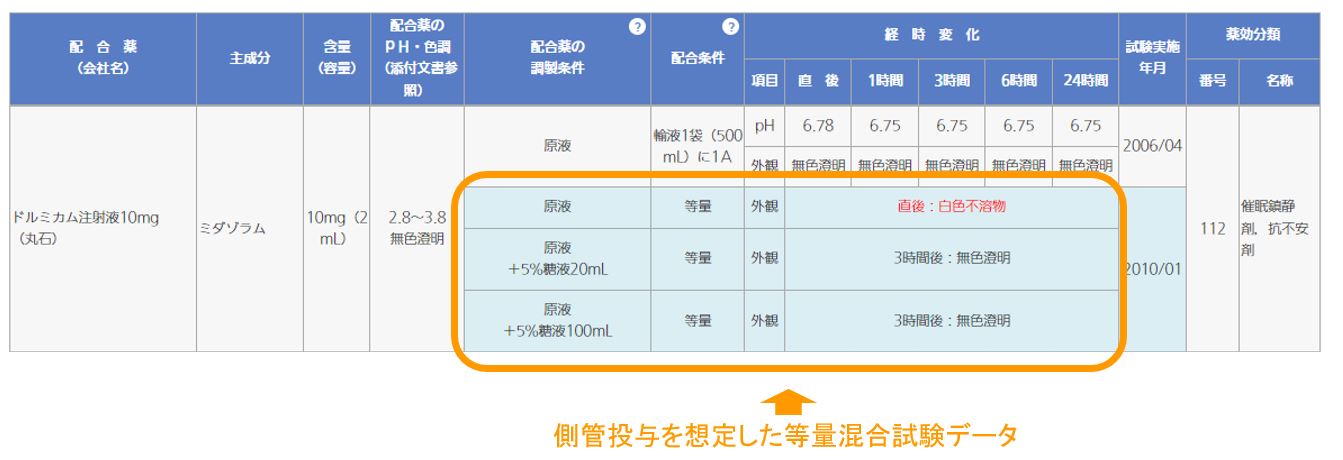
側管投与時の参考情報として、輸液と各種注射剤の等量混合試験データを、 医療関係者向け情報サイト内、「配合変化・容器」ページの配合変化表の中に掲載しています。
ビーフリード輸液 配合変化表
-
脂肪を含む輸液はファイナルフィルターが使用できません。
脂肪乳剤であるイントラリポス輸液10%・20%、脂肪が含まれるミキシッドL・H輸液、エネフリード輸液は、脂肪粒子径が孔径 0.22 μm のファイナルフィルターより大きいので、ファイナルフィルターを通過することができません。粘性の高い輸液は、ファイナルフィルターは通過可能ですが、フィルター装着により滴下速度が遅くなることがあります1)。
【例】 デキストラン製剤 ( 低分子デキストランL注・糖注、サヴィオゾール輸液 )
高濃度糖液 ( 大塚糖液50%、70% )
キドパレン輸液1) 大塚製薬工場 社内資料(粘度が高い輸液製剤のファイナルフィルターの通過性および輸液セットからの流出時間)
-
第十八改正日本薬局方 一般試験法の注射剤の採取容量試験法 〈 6.05 〉 には、「表示量よりやや過剰に採取できる量が充填されていること」 との記載があり、通常、輸液製品は表示量より過量に充填されています。
【参考】第十六改正 日本薬局方 第二追補より、注射用水(容器入り)では採取容量試験の項目は削除されています。





