- HOME
- よくある質問/お問い合わせ
- エネフリード輸液の製品Q&A
エネフリード輸液の製品Q&A
- No.
- お問い合わせ
- お問い合わせ項目
-
ビーフリード輸液、エネフリード輸液の中心静脈内投与は、用法外使用です。
末梢静脈内に点滴静注する製品として承認を受けているためです。ビーフリード輸液
6.用法及び用量 通常、成人には1回 500mLを末梢静脈内に点滴静注する 1)。エネフリード輸液
6.用法及び用量 通常、成人には1回550mLを末梢静脈内に点滴静注する2)。1) ビーフリード輸液 電子添文 2022年12月改訂(第1版)
2) エネフリード輸液 電子添文 2020年11月改訂(第2版) -
本剤に他剤を混注しないよう電子添文に以下の通り注意書き1)をしておりますので、配合変化試験は行っていません。
本剤に配合されている成分(電解質など)も混注できません。
本剤の性状(混合時:微黄色の乳濁液)上、外観で細菌汚染・配合変化を確認できず、また細菌が混入すると増殖しやすいためです。【参考】1)
14.適用上の注意
14.1全般的な注意(抜粋)
本剤は、含有する脂肪が目詰まりするため、除菌用ファイナルフィルターを使用できない。外観で細菌汚染・配合変化を確認できず、また、細菌が混入すると増殖しやすいため、以下の点に注意すること。
・本剤に他の薬剤を混注しないこと。
・本剤の輸液ラインの側管から他の薬剤を投与しないこと。1) エネフリード輸液 電子添文 2020年11月改訂(第2版)
2) Otsuka InformationVol.114 エネフリード輸液 他の薬剤を混注・側注しないでください -
①遮光カバーがある場合
室温散乱光下(500lx)では、混合後 3 日までは、アセチルシステイン、リボフラビンリン酸エステルナトリウムおよびアスコルビン酸の含量は表示量の90%以上となり、脂肪粒子の粗大化による不溶性微粒子の増大は認められませんでした。
②遮光カバーがない場合
室温散乱光下(500lx)では、混合後 24 時間までは、アセチルシステイン、リボフラビンリン酸エステルナトリウムおよびアスコルビン酸の含量は表示量の90%以上となり、脂肪粒子の粗大化による不溶性微粒子の増大は認められませんでした。エネフリード輸液 インタビューフォーム 2020年12月改訂(第2版)
-
以下、組成表をご確認ください。
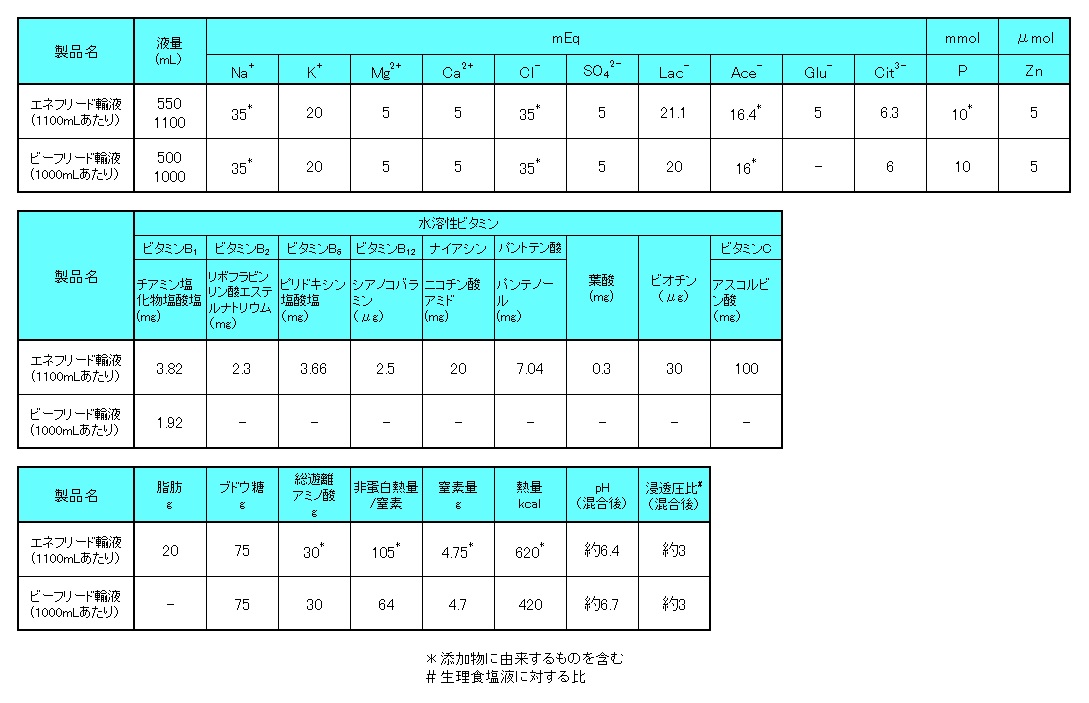
1) エネフリード輸液 電子添文 2020年11月改訂(第2版)
2) ビーフリード輸液 電子添文 2022年12月改訂(第1版) -
脂肪を含む輸液はファイナルフィルターが使用できません。
脂肪乳剤であるイントラリポス輸液10%・20%、脂肪が含まれるミキシッドL・H輸液、エネフリード輸液は、脂肪粒子径が孔径 0.22 μm のファイナルフィルターより大きいので、ファイナルフィルターを通過することができません。粘性の高い輸液は、ファイナルフィルターは通過可能ですが、フィルター装着により滴下速度が遅くなることがあります1)2)。
【例】 デキストラン製剤 ( 低分子デキストランL注・糖注、サヴィオゾール輸液 )
ボルベン輸液
高濃度糖液 ( 大塚糖液50%、70% )
キドパレン輸液1) 大塚製薬工場 社内資料(粘度が高い輸液製剤のファイナルフィルターの通過性および輸液セットからの流出時間)
2) 大塚製薬工場 社内資料(ボルベン輸液6%のファイナルフィルターの通過性)



