- HOME
- よくある質問/お問い合わせ
- 医療用医薬品/医療機器
医療用医薬品(輸液、ラコール、ツインライン等)・医療機器に関するよくある質問と回答
- No.
- お問い合わせ
- 製品カテゴリ
- 項目
-
経腸用半固形剤専用アダプタ(ISO80369-3)およびラコールNF配合経腸用半固形剤専用アダプタ(ISO80369-3)は再使用禁止です。
専用アダプタ(ISO80369-3)の先端が摩耗・変形していると、口栓(スパウト部位)が開通しない恐れがありますので、使用する前に異状がないことを確認してください。また、専用アダプタを刺し込む向きにも注意してください。
【使用方法】
①イノソリッド配合経腸用半固形剤・ラコールNF配合経腸用半固形剤のバッグや口栓が操作台と平行になるように置いてください。
その後、専用アダプタの取っ手がバッグの面に垂直になるようにし、口栓に専用アダプタをまっすぐ 刺し込み、内部のフィルムに穴をあけます。
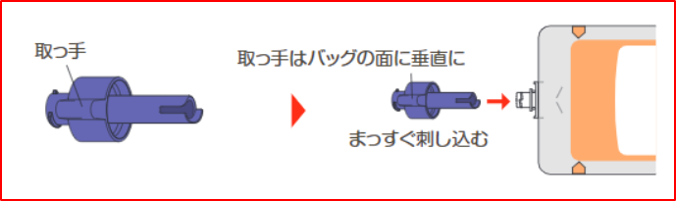

一旦フィルムが伸びてしまうと、新しい専用アダプタを刺しても開通できません。

②専用アダプタを右に回して、ねじ込みます(3/4回転させます。)

はじめての半固形剤注入法の手びき(ISO80369-3対応)
ISO80369-3対応半固形剤専用アダプタを用いた注入方法(動画)
ISO80369-3対応経腸用半固形剤専用アダプタを用いた投与手順(PDF) -
以下のような状態が現れた場合は交換の目安です。ご使用を中止してください。
【保管方法及び有効期間等】1)
<耐用期間>
以下の劣化の状態が現れた場合は使用限界である。
1. 破損(特に接合部分)、ひび割れ、変形等が認められる場合
2. 加圧バッグ溶着部が伸びて剥がれはじめた場合
3. 加圧した時、加圧バッグやエアホース等から空気漏れが認められ、圧力ゲージの青色が見えない場合
4. 明らかに十分な加圧や排気が行われているにも関わらず、圧力ゲージの目盛部の位置が動かない場合
5. 加圧した時、圧力ゲージの赤色が見える場合修理対応はいたしかねますので、壊れた場合は新しい製品をご準備ください。
なお、半固形栄養剤用加圧バッグは消耗品ですので、使用開始後短期間で使用限界に達する場合があります。1)半固形栄養剤用加圧バッグ 電子添文2023年12月改訂(第5版)
-
以下の内容をご確認いただき、対応ください。
1. 栄養剤を投与する際は「水色のコック」を以下のように正しい向きに合わせてください1)。
コックの向きが正しくない場合、空気がぬけ、投与に時間がかかるおそれがあります。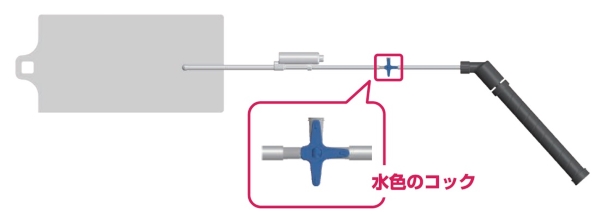
2. ポンプには以下①~④の4か所にネジ部があります。ポンプのネジが緩んでいる時は、締め直してください。
分解はしないでください。分解すると内部の重要な部品が脱落したり、位置がずれたりして、使用できなくなるおそれがあります。
なお、バッグ溶着部が剥がれている場合は、新しい製品をご準備ください。
1)半固形栄養剤用加圧バッグ 電子添文2023年12月改訂(第5版)
-
栄養剤や汚れ等が付着した場合は、水又はぬるま湯を浸してよくしぼったガーゼ等で速やかにふきとり、乾いた柔らかい布等で水気をふきとってください。
バッグ本体及び各部品が破損するおそれがあるため、アルコール、消毒剤、液体洗剤、除菌シート等は使用しないでください。【使用上の注意】1)
〈重要な基本的注意〉
2. アルコール、消毒剤、液体洗剤等を接触させないこと。[加圧バッグの破裂や破損が生じるおそれがある。また、三方活栓、手動ポンプ又は圧力ゲージにひび割れが生じ、空気漏れが生じるおそれがある。]
3. 本品を、流水又は水没させて洗浄しないこと。また、使用中、本品に栄養剤等が付着した場合は、水又はぬるま湯に浸してよくしぼったガーゼ等で速やかにふきとり、乾いた柔らかい布等で水気をふきとること。1)半固形栄養剤用加圧バッグ 電子添文2023年12月改訂(第5版)
-
トルバプタンOD錠7.5mg・15mg「オーツカ」は、サムスカOD錠のオーソライズド・ジェネリック(AG)です。
サムスカOD錠と有効成分・原薬製造・添加剤・製法・製造所は同じです。トルバプタンOD錠7.5mg・15mg「オーツカ」は、先発品(サムスカOD錠7.5mg・15mg)と効能又は効果は同じではありません。
トルバプタンOD錠7.5mg・15mg「オーツカ」の効能又は効果は、以下のとおりです。4. 効能又は効果1)
〈トルバプタンOD錠7.5mg「オーツカ」〉
〇ループ利尿薬等の他の利尿薬で効果不十分な心不全における体液貯留
○ループ利尿薬等の他の利尿薬で効果不十分な肝硬変における体液貯留
〈トルバプタンOD錠15mg「オーツカ」〉
○ループ利尿薬等の他の利尿薬で効果不十分な心不全における体液貯留先発品(サムスカOD錠7.5mg・15mg)にある効能又は効果「抗利尿ホルモン不適合分泌症候群(SIADH)における低ナトリウム血症の改善」および「腎容積が既に増大しており、かつ、腎容積の増大速度が速い常染色体優性多発性のう胞腎の進行抑制」は、承認されていません。
1)トルバプタンOD錠7.5mg/15mg「オーツカ」電子添文2023年12月改訂(第5版)
-
トルバプタンOD錠7.5mg/15mg「オーツカ」は、必ず入院下で投与開始又は再開してください。
1. 警告1)
本剤投与により、急激な水利尿から脱水症状や高ナトリウム血症を来し、意識障害に至った症例が報告されており、また、急激な血清ナトリウム濃度の上昇による浸透圧性脱髄症候群を来すおそれがあることから、入院下で投与を開始又は再開すること。また、特に投与開始日又は再開日には血清ナトリウム濃度を頻回に測定すること。8. 重要な基本的注意1)
<効能共通>
8.5 また、本剤の投与初期から重篤な肝機能障害があらわれることがあるため、本剤投与開始前に肝機能検査を実施し、少なくとも投与開始2週間は頻回に肝機能検査を行うこと。やむを得ず、その後も投与を継続する場合には、適宜検査を行うこと。1)トルバプタンOD錠7.5mg/15mg「オーツカ」電子添文2023年12月改訂(第5版)
-
トルバプタンOD錠7.5mg・15mg「オーツカ」を単剤で投与することは用法外使用です。
本剤は、水排泄を増加させますが、ナトリウム排泄を増加させないことから、本剤が効能又は効果を有する「ループ利尿薬等の他の利尿薬で効果不十分な心不全における体液貯留」および「ループ利尿薬等の他の利尿薬で効果不十分な肝硬変における体液貯留」に対しては他の利尿薬(ループ利尿薬、サイアザイド系利尿薬、抗アルドステロン薬等)と併用してご使用ください。なお、ヒト心房性ナトリウム利尿ペプチドとの併用経験はありません1)。1)トルバプタンOD錠7.5mg/15mg「オーツカ」電子添文2023年12月改訂(第5版)
-
弊社輸液製品につきましては、医療用の医薬品として製造販売しておりますので、その目的で使用している場合は各種証明書を発行させていただきます。(医療機関宛)
それ以外の目的で製品を使用している場合の各種証明書発行は、お断りさせていただいております。
なお、品質に関する情報提供といたしましては、試験成績書の発行1)のみ対応させていただいております。
-
「経腸用半固形剤専用アダプタ」と「ラコールNF配合経腸用半固形剤専用アダプタ」の形状は同じです。
イノソリッド配合経腸用半固形剤の発売に伴い、ラコールNF配合経腸用半固形剤専用アダプタから経腸用半固形剤専用アダプタに名称変更し、各種コードが変更になりました。経腸用半固形剤専用アダプタ(ISO 80369-3 タイプ) 新発売、ラコールNF 配合経腸用半固形剤専用アダプタ(ISO 80369-3 タイプ) 販売中止のご案内
経腸用半固形剤専用アダプタ(旧規格) 新発売、ラコールNF 配合経腸用半固形剤専用アダプタ(旧規格) 販売中止のご案内 -
イノソリッド配合経腸用半固形剤は、新医薬品ではなく医療用医薬品(9の2)類似処方医療用配合剤として製造販売承認を取得しています。そのため、新医薬品にかかる処方日数制限は受けません。
-
イノソリッド配合経腸用半固形剤は、製剤の特性上、外観からは内容成分の変質が判断しにくいため、開封後の保存は避けてください。
開封後は、微生物汚染及び直射日光を避け、できるだけ早めに使い切ってください。
やむを得ず保管する場合は、冷蔵庫に保管し、開封後24時間以内に使い切ってください1)。
【参考】
内容成分の安定性は、25±2℃、60±5%RH、1000±100 lxの条件下で24時間まで規格内であることを確認しています2)。1) イノソリッド配合経腸用半固形剤 電子添文 2024年11月改訂(第2版)
2) イノソリッド配合経腸用半固形剤 インタビューフォーム 2024年11月改訂(第2版) -
輸液の容器の材質は、各製品毎のインタビューフォームに掲載しております。
日本病院薬剤師会のIF記載要領2018(2019年更新版)に準拠して作成版
Ⅳ.製剤に関する項目
10.容器・包装
(4)容器の材質
または
日本病院薬剤師会のIF記載要領2008に準拠して作成版
X.管理的事項に関する項目
7.容器の材質
各製品のインタビューフォームは、医療関係者向け情報サイト内「医療用医薬品情報」ページに掲載しております。医療用医薬品情報|【公式】大塚製薬工場医療関係者向けページOtsuka Pharmaceutical Factory, Inc. (otsukakj.jp)
-
下記資料があります。医療関係者向け情報サイトからダウンロード、または営業担当者にご要望ください。
1) くすりのしおり:トルバプタンOD錠7.5mg「オーツカ」
2) くすりのしおり:トルバプタンOD錠15mg「オーツカ」
3) 患者向医薬品ガイド
4) 心不全用:入院でトルバプタンを開始し、外来で継続服用される方へ(心不全編)
5) 肝硬変用:入院でトルバプタンを開始し、外来で継続服用される方へ(肝硬変編)
6) トルバプタンOD錠「オーツカ」を服用される患者さんへ(20枚綴り服薬指導箋) -
イノソリッド配合経腸用半固形剤またはラコールNF配合経腸用半固形剤の口栓(スパウト部位)を持ち、バッグが折れ曲がった状態で専用アダプタを接続すると、専用アダプタの先端でバッグの内側を傷つける恐れがあります。専用アダプタを口栓へ接続するときは、バッグや口栓が操作台と平行になるように置いてください。

-
経腸用半固形剤専用アダプタ(旧規格)およびラコールNF配合経腸用半固形剤専用アダプタ(旧規格)は再使用禁止です。
専用アダプタ(旧規格)の先端が摩耗・変形していると、口栓(スパウト部位)が開通しない恐れがありますので、使用する前に異状がないことを確認してください。また、専用アダプタはまっすぐ一気に刺し込んでから、右に回してください。【使用方法】
①イノソリッド配合経腸用半固形剤・ラコールNF配合経腸用半固形剤のバッグや口栓が操作台と平行になるように置いてください。その後、口栓に専用アダプタをまっすぐ一気に刺し込み、内部のフィルムに穴をあけます。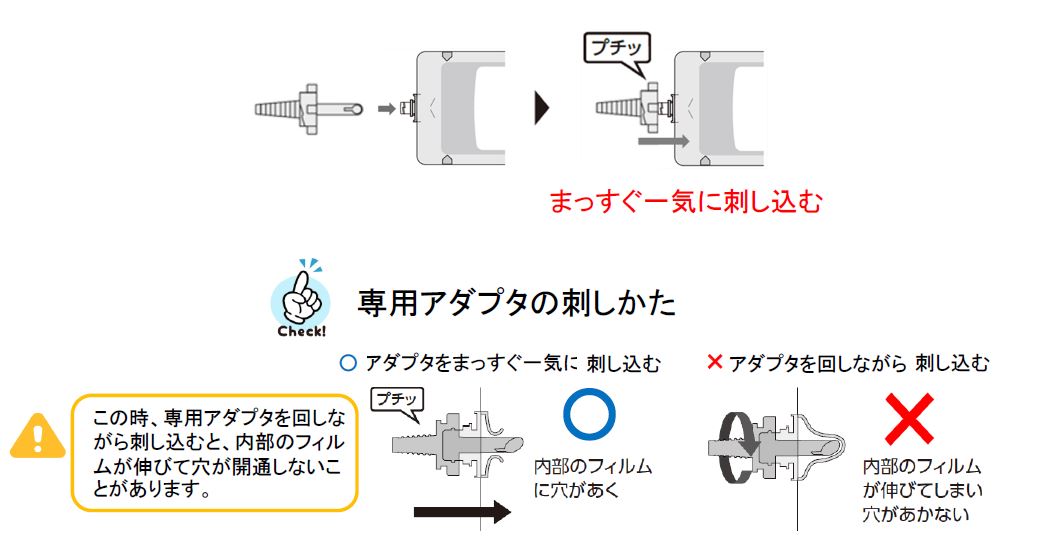
一旦フィルムが伸びてしまうと、新しい専用アダプタを刺しても開通できません。
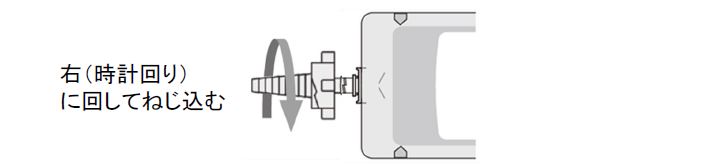
②専用アダプタを右に回して、最後までねじ込みます。
ラコールNF配合経腸用半固形剤専用アダプタを用いた注入方法(動画)
経腸用半固形剤専用アダプタ(旧規格)を用いた投与手順(PDF)
Otsuka Information ラコールNF配合経腸用半固形剤専用アダプタ操作時のポイント(Vol.111) -
投与直前に開封し、A液とB液を混合して速やかに投与を開始し、12時間以内に終了してください。1)2)
IV.製剤に関する項目
6.製剤の各種条件下における安定
【A液・B液開封後の安定性/通常の室内条件(25℃750lx蛍光)下】2)A液 : 12時間まで規格内
B液 : 8時間まで規格内IV.製剤に関する項目
7.調製法及び溶解後の安定性
【A液・B液溶解後の安定性/通常の室内条件(25℃750lx蛍光)下】2)A液B液混合液 : 12時間まで規格内
( 注意 )
菌汚染について検討しておらず、一度口をつけた残液は廃棄してください。1) ツインラインNF配合経腸用液 電子添文 2022年4月改訂(第1版)
2) ツインラインNF配合経腸用液 インタビューフォーム 2022年9月改訂(第3版) -
キット製剤を除く大塚生食注 ( 日局 生理食塩液 ) のみ、用法として皮下投与の適応があります 1)。
【参考】
近年では、末梢静脈のルート確保が困難な患者や在宅高齢者の軽~中等度脱水、終末期医療において、特に持続皮下注射 ( 500 ~ 1500 mL / 24hr ) が見直されています 2)。1) 大塚生食注 電子添文 2023年5月改訂(第1版)
2) 緩和医療ガイドライン委員会: 終末期がん患者の輸液療法に関するガイドライン2013年版(編集 特定非営利活動法人 日本緩和医療学会 緩和医療ガイドライン委員会),金原出版株式会社 2013:p41-43 【ZA30513A03】 -
ツインラインNF配合経腸用液は 80 ℃ 以上の高温を避け 1) 、ラコールNF配合経腸用液は 70 ℃ 以上の高温を避け 2) 、イノラス配合経腸用液は70℃以上の高温を避け 3)、いずれも未開封のまま湯煎にて温めてください。
<注意>電子レンジでの加温は皮膜が形成されるおそれがあるので、原則は避けるようにお願いします。やむを得ず、電子レンジで加温する場合は、アルミ容器のまま電子レンジで加温すると発火や容器破損の恐れがあるため、必要分だけ別容器に移し替えてください。
1) ツインラインNF配合経腸用液 電子添文 2022年4月改訂(第1版)
2) ラコールNF配合経腸用液 電子添文 2022年6月改訂(第1版)
3) イノラス配合経腸用液 電子添文 2023年5月改訂(第2版) -
開封後は、微生物汚染及び直射日光を避け、できるだけ早めに使い切ってください。やむを得ず冷蔵庫内に保存する場合は、24時間以内に使い切ってください。1)
(注意)
菌汚染について検討しておりませんので、一度口をつけた残液は廃棄してください。1) ラコールNF配合経腸用液 電子添文 2022年6月改訂(第1版)
-
ラコールNF配合経腸用液・ラコールNF配合経腸用半固形剤・ツインラインNF配合経腸用液には乳糖は含まれていません。従って、乳糖不耐症の方にも投与は可能です。
イノラス配合経腸用液には、原料(濃縮乳たん白質)由来の乳糖が、0.86g以下/187.5mL、0.57g以下/125mL、含まれています1)。
イノソリッド配合経腸用半固形剤には、原料(濃縮乳たん白質)由来の乳糖が、0.96g以下/300g含まれています2)。
乳糖不耐症の方へ投与する場合は臨床症状に注意して適切に投与してください。1) イノラス配合経腸用液 電子添文 2023年5月改訂(第2版)
2) イノソリッド配合経腸用半固形剤 電子添文 2024年11月改訂(第2版) -
大塚糖液 ( 日本薬局方 ブドウ糖注射液 ) の皮下投与は用法外使用です 1)。
糖液の皮下大量投与により、血漿中から電解質が移動し循環不全を招くおそれがありますので、皮下投与はできません 1) 2)。
1) 大塚糖液5・10・20・40・50・70% 電子添文 2024年3月改訂(第1版)
2) 緩和医療ガイドライン委員会: 終末期がん患者の輸液療法に関するガイドライン2013年版(編集 特定非営利活動法人 日本緩和医療学会 緩和医療ガイドライン作成委員会),金原出版 2013:p41-43 【ZA30513A03】 -
ツインラインNF配合経腸用液のA液には脂肪、炭水化物、ビタミンの一部 ( 主に脂溶性ビタミン )、B液には窒素源 ( 乳たん白加水分解物・アミノ酸 )、電解質、水溶性ビタミンを配合しています1)。1剤化した場合、乳たん白加水分解物のアミノ酸と炭水化物のブドウ糖が加熱滅菌時にメイラード反応を起こすため、A液とB液の2液に分けました。
1) ツインラインNF配合経腸用液 インタビューフォーム 2022年9月改訂(第3版)
-
ラコールNF配合経腸用液の経管投与時の速度は、通常 75~125 mL/時間です。なお、年齢、体重、症状により、適宜増減します 1)。
投与速度が速いと、糖質が急速に小腸へ流入するため血糖値が上昇したり、下痢、胃の膨満や逆流、嘔吐の原因になるおそれがあります 2)。
更に、急速投与後には、ダンピング症候群様の低血糖になり、倦怠感、発汗、冷汗などの症状が現れることがあります 3)。
遅いと、微生物増殖の問題が懸念されます。
溶解・希釈を行う製剤では8時間以内に、RTH(ready-to-hang)製剤*では24時間以内に投与を完了する、とされております4)。*RTH製剤とは、栄養セットを接続することでそのまま投与することができるバッグ型製剤です。
1) ラコールNF配合経腸用液 電子添文 2022年6月改訂(第1版)
2) 編集/井上善文, 足立香代子:経腸栄養剤の種類と選択 改訂版,フジメディカル出版 2005;p108-128
3) 足立聡:在宅医療と内視鏡治療,2002;32(6):32-35【ET10502F01】
4) 編集/日本静脈経腸栄養学会:静脈経腸栄養ガイドライン 第3版,照林社 2013:p118-119 -
大塚糖液 ( 日本薬局方 ブドウ糖注射液 ) の用法及び用量は静脈内注射のみ1)であり、経口あるいは経管投与することは用法外使用です。
1) 大塚糖液5・10・20・40・50・70% 電子添文 2024年3月改訂(第1版)
-
新しい組成『New Formula』という意味です1)。
2011年8月まで販売していたラコール配合経腸用液の組成の中で、フィトナジオン ( ビタミンK1 ) を 1/10 に減量し、12.5 μg / 200 mL としました。
1) ラコールNF配合経腸用液 インタビューフォーム 2023年1月改訂(第5版)
-
ラコールNF配合経腸用液に配合されているナトリウムの食塩相当量は以下の通りです。
ラコールNF配合経腸用液 ( 200 mL ) の食塩相当量 0.38 g
ラコールNF配合経腸用液 ( 400 mL ) の食塩相当量 0.76 gラコールNF配合経腸用液に直接食塩を添加する事はお勧めしません。
蛋白の凝集分離や、油分の乳化が壊れる可能性があり、チューブ閉塞の原因になることがあります。1) ラコールNF配合経腸用液 電子添文 2022年6月改訂(第1版)
-
ラコールNF配合経腸用液・イノラス配合経腸用液を凍結することは避けてください 1)2)。
凍結融解した場合、乳化が不安定になり、油分と水分が分離する可能性があります。
1) ラコールNF配合経腸用液 電子添文 2022年6月改訂(第1版)
2) イノラス配合経腸用液 電子添文 2023年5月改訂(第2版) -
イノラス配合経腸用液、イノソリッド配合経腸用半固形剤、ラコールNF配合経腸用液、ラコールNF配合経腸用半固形剤の成分に対し過敏症の既往歴のある患者、牛乳たん白アレルギーを有する患者は禁忌に該当します 1)2)3)4)。また、ツインラインNF配合経腸用液の成分に対し過敏症の既往歴のある患者は禁忌に該当します5)。
イノラス配合経腸用液には「濃縮乳たん白質」と「カゼインナトリウム」が配合されているため、牛乳アレルギーのある患者に投与することはできません。大豆由来の成分は含まれておりませんので、大豆アレルギーのある患者には投与可能です。
イノソリッド配合経腸用半固形剤には、「濃縮乳たん白質」と「カゼインナトリウム」が配合されているため、牛乳アレルギーのある患者に投与することはできません。
「ダイズ油」が配合されており、ダイズ油中のアレルゲンに関する詳細な知見は得ておりませんが、、大豆由来アレルゲン以外の物質に対してもアレルギー反応が出てくる可能性がありますので、大豆アレルギーのある患者の場合は十分に経過観察を行いながら投与してください。ラコールNF配合経腸用液及びラコールNF配合経腸用半固形剤には「乳カゼイン」と「分離大豆たん白質」が配合されているため、牛乳アレルギーや大豆アレルギーのある患者に投与することはできません。
ツインラインNF配合経腸用液には 「乳たん白加水分解物」と「大豆レシチン(乳化剤)」が配合されているため、牛乳アレルギーや大豆アレルギーのある患者に投与することはできません。
【参考】
牛乳たん白アレルギーを有する患者に、牛乳たん白を含む経腸栄養剤を投与し、アナフィラキシーショックを起こした報告があります 6)7)。1) イノラス配合経腸用液 電子添文 2023年5月改訂(第2版)
2) イノソリッド配合経腸用半固形剤 電子添文 2024年11月改訂(第2版)
3) ラコールNF配合経腸用液 電子添文 2022年6月改訂(第1版)
4) ラコールNF配合経腸用半固形剤 電子添文 2022年4月改訂(第1版)
5) ツインラインNF配合経腸用液 電子添文 2022年4月改訂(第1版)
6) ラコールNF配合経腸用液 インタビューフォーム 2023年1月改訂(第5版)
7) ラコールNF配合経腸用半固形剤 インタビューフォーム 2022年10月改訂(第6版) -
ビーフリード輸液を隔壁開通・混合後に室内散乱光下 ( 約 500 lx ) で保存したところ、7日後の含量は、いずれの試験項目も表示量の95%以上でした 1)。
1)ビーフリード輸液 インタビューフォーム 2023年3月改訂(第10版)
-
ビーフリード輸液は、アミノ酸の酸化を防ぐために酸素バリア外袋によって包装していますので、外袋開封後は、上室のアミノ酸(主にトリプトファン)の酸化による着色が起こります。1)
隔壁開通後の混合液では、上記のアミノ酸の酸化に加え、更にメイラード反応による着色が起こります。2)3)
外袋は使用時まで開封しないでください4)。また、外袋の破損などお取り扱いにご注意ください。5)6)
配合変化や微生物汚染によって着色が起こることもあります。7)1) Otsuka Information Vol.86 アミノ酸輸液の着色にご注意ください
2) ダブルバッグには理由があります(資材番号:4063)
3) Otsuka Information Vol.13 ダブルバッグには理由があります
4) ビーフリード輸液 電子添文 2022年12月改訂(第1版)
5) Otsuka InformationVol.3 バッグ入りアミノ酸輸液の取扱い
6) Otsuka InformationVol.4 バッグ入りアミノ酸液の取り扱いはやさしく・・・
7) Otsuka InformationVol.99 輸液管理時の清潔操作 -
カルシウム(Ca)やリン(P)を高濃度に含む補正用電解質液 (塩化Ca補正液1mEq/mLや大塚塩カル注2% 等) との配合には注意が必要です。
一方、CaやPの濃度が同程度の電解質輸液 (フィジオ35 等) との混合では、沈殿混濁を生じないこともあります。
ビーフリード輸液には、CaとPが配合されており、かつ血管痛予防の観点からpHを中性に近い約6.7にしています。
そのため他剤の配合により、CaやPの濃度が高くなったり、溶液のpHがアルカリ性に傾いたりすると、難溶性のリン酸カルシウムの結晶が析出することがあります。詳しくは、ビーフリード輸液 配合変化表をご参照下さい。
-
ビーフリード輸液の組成はアミノ酸濃度3%、糖濃度7.5%であり、うっ血性心不全のある患者に対して十分な栄養素を補給する場合、水分負荷がかかり、症状を悪化させるおそれがあるため、禁忌となりました1)。
1)ビーフリード輸液 電子添文 2022年12月改訂(第1版)
-
ビーフリード輸液、エネフリード輸液の中心静脈内投与は、用法外使用です。
末梢静脈内に点滴静注する製品として承認を受けているためです。ビーフリード輸液
6.用法及び用量 通常、成人には1回 500mLを末梢静脈内に点滴静注する 1)。エネフリード輸液
6.用法及び用量 通常、成人には1回550mLを末梢静脈内に点滴静注する2)。1) ビーフリード輸液 電子添文 2022年12月改訂(第1版)
2) エネフリード輸液 電子添文 2020年11月改訂(第2版) -
輸液関連製品等の廃棄方法は、医療機関と家庭では取り扱い方法が異なります。以下に概略をお示ししますが、詳細については院内マニュアルや各市区町村の役所にご確認ください。
①医療関係機関等で廃棄する場合(産業廃棄物)
事業活動にて発生する廃棄物なので産業廃棄物として取り扱い、さらに、感染性廃棄物と非感染性廃棄物に大別します 1) 2)。●非感染性廃棄物(例)
輸液バッグ、輸液ボトル 、経腸栄養剤の容器、包材(外装ケース、外袋、ピールシール) 等●感染性廃棄物(例)
TNや2ポート製品のトランスファーニードル部分、局所洗浄用ノズル、輸液セット、破損したガラスアンプル等②家庭で廃棄する場合(一般廃棄物)
家庭では感染性の有無に関わらず、鋭利なものと非鋭利なものとに大別して処理することが提唱されています 3)。●鋭利なもの(例)
注射針や輸液セット(血液等が付着していなくとも)、局所洗浄用ノズル、破損したガラスアンプル等
プラスチックなどの針を通さない蓋付きの容器に入れ、医療機関に引き取ってもらい感染性廃棄物として処理します。●非鋭利なもの(例)
輸液バッグ、輸液ボトル 、輸液ライン(針部以外)、包材(外装ケース、外袋、ピールシール) 等
可燃ごみ、不燃ごみなど、市区町村の分別方法に従って廃棄します。但し、在宅医療廃棄物は一般廃棄物であることから、市区町村が一般廃棄物処理計画に従って、その区域内おける当該廃棄物を生活環境の保障上支障が生じないように収集・運搬・及び処理を行わなければなりません 4)。
そのために、取り扱いは各市区町村で取り扱いが異なることがあります。詳細については、行政へ確認してください。<補足>
輸液セットは、そのままでは鋭利なものに分類されますが、針部とその他(輸液ライン)とに分けて、前者を鋭利なもの、後者を非鋭利なものとして処理する場合もあります。【参考】
1) 日本病院薬剤師会学術委員会、日本製薬工業協会環境安全委員会
医薬品容器包装等の廃棄に関する手引き 改訂版 2007年2月 (2024年7月現在)
2) 平成24年5月10日 環廃産発第120510001号
3) 平成17年9月8日 環廃対発050908003号・環廃産発050908001号
4) 平成10年7 月30日 衛環第71号 -
イノソリッド配合経腸用半固形剤およびラコールNF配合経腸用半固形剤の経口投与は用法外使用です。
安全性の検討なども行っていません。
特に、嚥下障害のある患者では誤嚥などのおそれもありますので経口投与しないようにしてください。イノソリッド配合経腸用半固形剤
6.用法及び用量(抜粋)1)
通常、成人標準量として1日900~1,500g(900~1,500kcal)を胃瘻より胃内に1日数回に分けて投与する。ラコールNF配合経腸用半固形剤
6. 用法及び用量(抜粋)2)
通常、成人標準量として1日1,200~2,000g(1,200~2,000kcal)を胃瘻より胃内に1日数回に分けて投与する。1) イノソリッド配合経腸用半固形剤 電子添文 2024年11月改訂(第2版)
2) ラコールNF配合経腸用半固形剤 電子添文 2022年4月改訂(第1版) -
ビーフリード輸液に他の薬剤を混合せず、室内散乱光下にて投与する場合は、遮光カバーをつける必要はありません 。
しかし、直射日光など光が強く当たる場合や、光分解されやすいビタミン剤などを混合した場合には、遮光カバーを用いるなど十分注意してください 1)。【参考】
・ビーフリード輸液の隔壁開通後、室内散乱光下(約500lx)で保存した安定性試験において、7日後の含量は、いずれの試験項目も表示量の95%以上であった 2)。
・ビタミンB1の光分解は短時間では起こりにくいが、状況に応じて遮光カバーを用いるなど、注意すること。また、その他ビタミン剤等を混合した場合には、ビタミンの光分解を防ぐため、遮光カバーを用いるなど、十分に注意すること 1)。1) ビーフリード輸液 電子添文 2022年12月改訂(第1版)
2) ビーフリード輸液 インタビューフォーム 2023年3月改訂(第10版) -
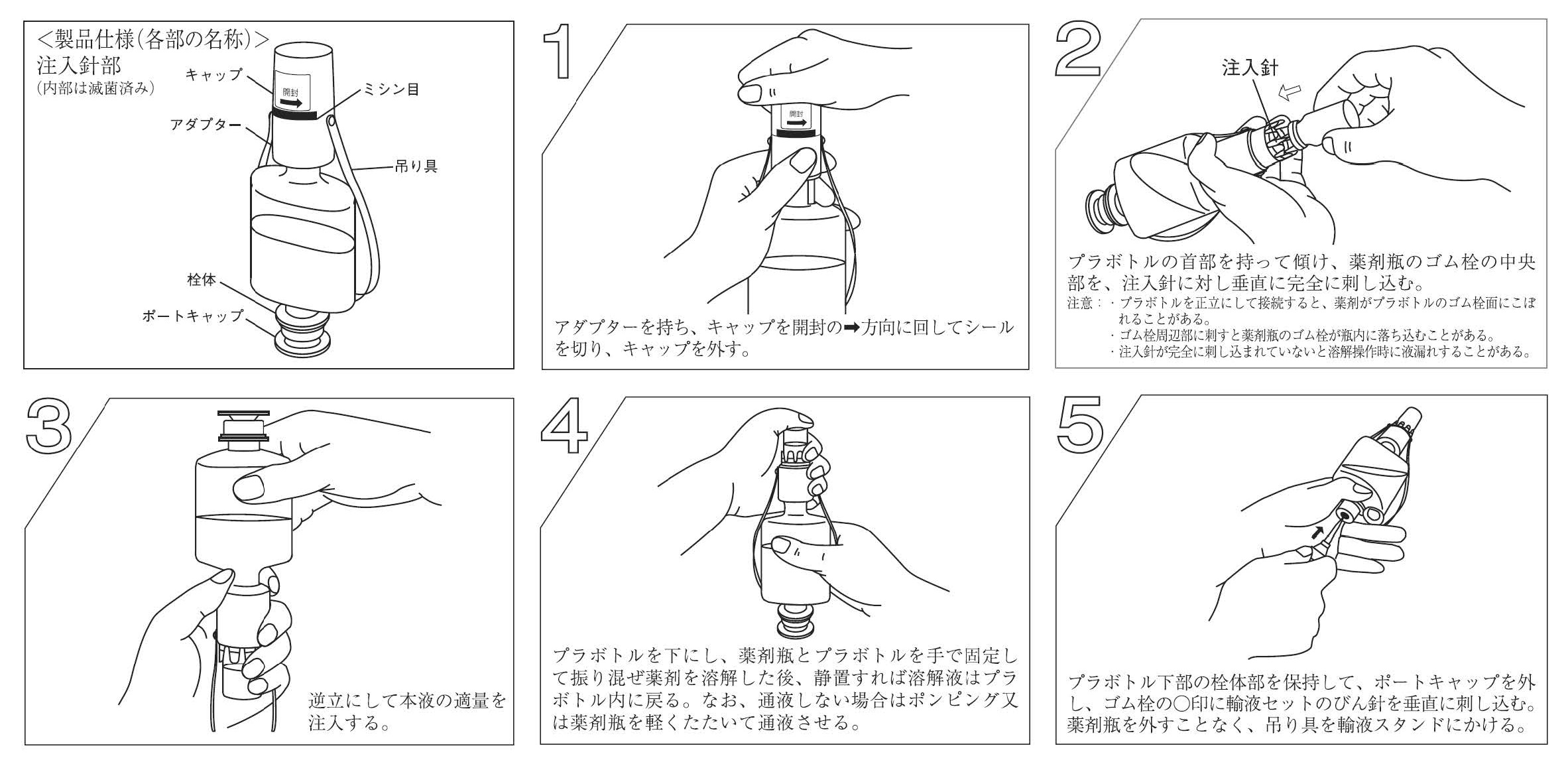
大塚生食注 50mL・100mL、大塚生食注TN 50mL・100mL、大塚生食注2ポート 50mL・100mL 、大塚糖液5%50mL・100mL、大塚糖液5%TN 50mL・100mL、大塚糖液5%2ポート 50mL・100mLの容器、効能・効果の違い、ハーフキット製品の溶解操作方法は下記の図表をご確認ください。
図 1 : (例)大塚生食注、大塚生食注TN、大塚生食注2ポートのラインアップ

表 1 : 容器形状、効能又は効果、用法及び用量比較1)~6)
製品名 大塚生食注
50mL・100mL大塚生食注TN
50mL・100mL大塚生食注2ポート
50mL・100mL容器 プラボトル
(ゴム栓付き)注入針付ハーフキット
(混注口と輸注口は同じ)注入針付ハーフキット
(混注口と輸注口は別)効能
又は
効果
〈注射〉
細胞外液欠乏時、ナトリウム欠乏時、クロール欠乏時、注射剤の溶解希釈剤〈外用〉
皮膚・創傷面・粘膜の洗浄・湿布、含そう・噴霧吸入剤として気管支粘膜洗浄・喀痰排出促進〈その他〉
医療用器具の洗浄注射剤の溶解希釈剤 注射剤の溶解希釈剤 製品名 大塚糖液5%
50mL・100mL大塚糖液5%TN
50mL・100mL大塚糖液5%2ポート
50mL・100mL容器 プラボトル
(ゴム栓付き)注入針付ハーフキット
(混注口と輸注口は同じ)注入針付ハーフキット
(混注口と輸注口は別)効能
又は
効果
○脱水症特に水欠乏時の水補給
○循環虚脱
○低血糖時の糖質補給
○高カリウム血症
○注射剤の溶解希釈剤
○薬物・毒物中毒
○心疾患(GIK療法)
○肝疾患
○その他非経口的に水・エネルギー補給を必要とする場合注射剤の溶解希釈剤 注射剤の溶解希釈剤 図 2 : 大塚生食注TN/大塚糖液5%TN溶解操作方法
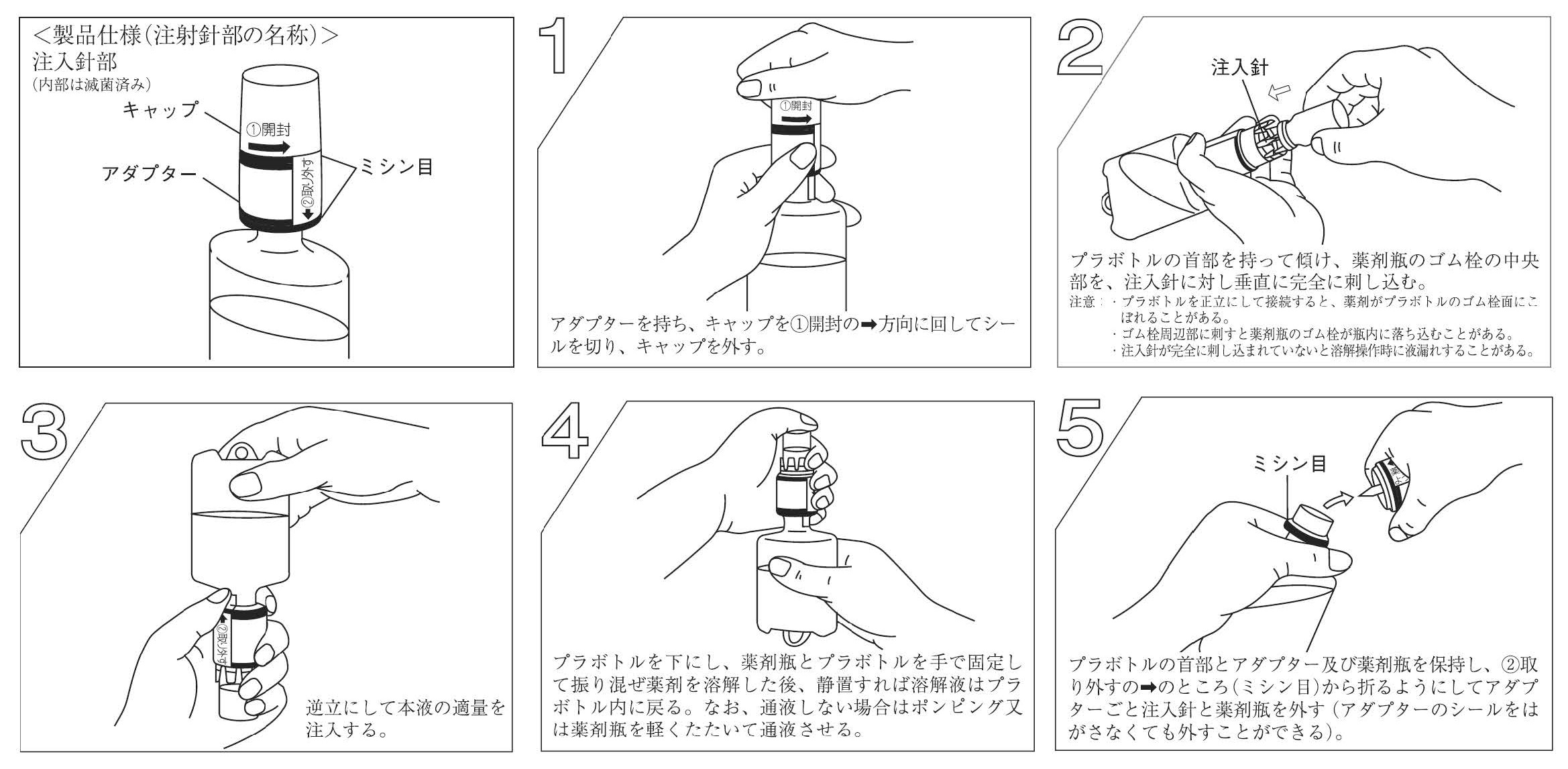
図 3 : 大塚生食注2ポート/大塚糖液5%2ポート溶解操方法
 1) 大塚生食注 電子添文 2023年5月改訂(第1版)
1) 大塚生食注 電子添文 2023年5月改訂(第1版)
2) 大塚生食注TN 電子添文 2023年5月改訂(第1版)
3) 大塚生食注2ポート50mL・ 大塚生食注2ポート100mL 電子添文 2023年5月改訂(第1版)
4) 大塚糖液5% 電子添文 2024年3月改訂(第1版)
5) 大塚糖液5%TN 電子添文 2023年11月改訂(第1版)
6) 大塚糖液5%2ポート50mL・大塚糖液5%2ポート100mL 電子添文 2023年11月改訂(第1版) -
イノソリッド配合経腸用半固形剤およびラコールNF配合経腸用半固形剤の空腸瘻や経鼻胃管からの投与は用法外使用です。
また、経鼻法や空腸瘻に用いるチューブ径は胃瘻チューブと比較すると細いため、薬剤の通過性が悪く、詰まりの原因になります。
さらに、本剤を短時間で腸瘻から投与すると、腹部膨満感・下痢・腹痛などの消化器症状を引き起こしたり、ダンピング症状が現れたりするおそれもあります。イノソリッド配合経腸用半固形剤
6.用法及び用量(抜粋)1)
通常、成人標準量として1日900~1,500g(900~1,500kcal)を胃瘻より胃内に1日数回に分けて投与する。ラコールNF配合経腸用半固形剤
6. 用法及び用量(抜粋)2)
通常、成人標準量として1日1,200~2,000g(1,200~2,000kcal)を胃瘻より胃内に1日数回に分けて投与する。1) イノソリッド配合経腸用半固形剤 電子添文 2024年11月改訂(第2版)
2) ラコールNF配合経腸用半固形剤 電子添文 2022年4月改訂(第1版) -
① 遮光カバー有の場合
室温散乱光下 ( 約 500 lx ) では、混合後 7 日までは、いずれの試験項目も表示量の90 %以上でした。② 遮光カバー無の場合
室温散乱光下 ( 約 500 lx ) では、混合後 24 時間までは、いずれの試験項目も表示量の90 %以上でした。エルネオパNF1号・2号輸液 インタビューフォーム 2024年11月改訂(第6版)
-
リン酸 Na 補正液の経口投与は、用法外使用です。
4. 効能又は効果1)
電解質補液の電解質補正
6. 用法及び用量1)
電解質補液の電解質の補正用として、体内の水分、電解質の不足に応じて電解質液に添加して用いる。【参考】
ゼリア新薬工業株式会社より、経口リン酸製剤「ホスリボン配合顆粒」が販売されています。4. 効能又は効果2)
低リン血症
5. 効能又は効果に関する注意2)
くる病や骨軟化症をきたす低リン血症の患者(原発性低リン血症性くる病・骨軟化症、Fanconi 症候群、腫瘍性骨軟化症、未熟児くる病等)に投与すること。1) リン酸Na補正液0.5mmol/mL 電子添文 2023年10月改訂(第1版)
2) ホスリボン配合顆粒 電子添文 2023年7月改訂(第1版) -
ブリスター包装内は滅菌していますので、使用時まで開封しないようお願いします1) 2)。
なお、ブリスター包装開封後は、アプリケータ表面の無菌状態は維持されません。
1) ポビドンヨード液10%消毒用アプリケータ「オーツカ」10mL・25mL 電子添文 2023年5月改訂(第1版)
2) オラネジン液1.5%消毒用アプリケータ10mL・25mL、オラネジン液1.5%OR消毒用アプリケータ10mL・25mL 電子添文 2024年10月改訂(第3版、再審査結果) -
HES ( ヒドロキシエチルデンプン ) やデキストラン40 は、糖質として利用可能なブドウ糖にまで分解される前に体外へ排泄されてしまうため、エネルギー源とはみなしません。従って、電子添文にカロリーの記載はありません。
-
経腸用半固形剤専用アダプタおよびラコールNF配合経腸用半固形剤専用アダプタ、半固形剤吸引用コネクタ、半固形栄養剤用加圧バッグは、特定保険医療材料ではありませんので保険償還されません。
-
セファゾリンNa点滴静注用1gバッグ「オーツカ」は腎障害、透析患者へは慎重投与です。セファゾリンNaは腎排泄型の薬剤のため腎障害患者へ投与すると排泄が遅れます。そのためクレアチニンクリアランス(Ccr、CrCl)を腎機能の指標とし、減量するか、投与間隔の延長等の調節が必要になります。参考情報として、各種ガイド等のCcr別の投与量は以下の表の通りです 1) 2) 3)。
■表1 サンフォード感染症治療ガイド(2024年)1)
CrCl 血液透析(HD) 腹膜透析(CAPD) 持続的腎代替療法(CRRT) >50~90 10~50 <10 1~2g
8時間ごと0.5~2g
8~12時間ごと0.5~1g
24時間ごと0.5~1g
24時間ごと(透析日は透析後投与)
外来患者
月曜日/水曜日に透析後2g、
金曜日に透析後3g0.5g静注
12時間ごと1~2g
12時間ごと■表2 JAID/JSC感染症治療ガイド(2023年)2)
Ccr (mL/分) 血液透析(HD) >50 10~50 <10 - 1回0.5~2g
- 1日2~3回
- (1日最大5g)
1回0.5~1g
1日2回1回1g・1日1回
または
2日に1回1回0.5~1g
毎HD後■表3 CKD診療ガイド(2012年)3)
Ccr (mL/分) 血液透析(HD) >50 10~50 <10 1~5gを
分2~31~2gを
分21回1g
24~48時間毎1回0.5~1g
毎HD後禁忌を含む注意事項等情報等については、電子添文をご参照ください。
1) 菊池賢・橋本正良 監修:表17A 腎障害のある成人患者への抗微生物薬の投与量,日本語版サンフォード感染症治療ガイド2024:p376【OPF001084】
2) JAID/JSC感染症治療ガイド・ガイドライン作成委員会:ⅩⅥ 耐性菌、ブレイクポイント、PK-PD,JAID/JSC感染症治療ガイド2023:p430【OPF000872】
3) 日本腎臓学会 編:付表 腎機能低下時の薬剤投与量,CKD診療ガイド2012:p121【CZ10512G01】 -
小児へのセファゾリンNa点滴静注用1gバッグ「オーツカ」の投与方法については、各種治療ガイド等 1) 2) 3) 4) の記載が参考となります。(下表参照。)
小児への投与時は臓器の発達や代謝能を十分考慮する必要があります。また、成人に比べて免疫能が未熟なため、重症化を考慮して治療計画を立てる必要があります。
■表1 サンフォード感染症治療ガイド 2024 1) 【表16 小児用量(生後>28 日】
薬剤 投与経路 用量(生後 > 28 日) セファゾリン 静注 50 ~ 150 mg/kg/日 6~8時間ごとに分割、1日最大 6g ■表2 JAID/JSC感染症治療ガイド 2023 2) 【新生児投与量:主に国内資料参照、保険適用含む】
薬剤 体重 < 1.2 kg 1.2 ~ 2 kg ≧ 2 kg 生後(日) ~28日 ~ 7日 7~28日 ~ 7日 7~28日 セファゾリン 1回投与量 20 mg/kg 20 mg/kg 20 mg/kg 20 mg/kg 20 mg/kg 1日投与回数 2回 2回 2回 2回 3回 ■表3 JAID/JSC感染症治療ガイド 2023 2) 【新生児投与量:主に国内資料参照、保険適用外含む】
薬剤 投与方法 胎児<32週 胎児≧32 生後<7日
生後≧7日 生後≦7日 生後>7日 セファゾリン 静注・筋注 25 mg/kg
12時間ごと25 mg/kg
8時間ごと50 mg/kg
12時間ごと50 mg/kg
8時間ごと
■表4 小児感染症治療ハンドブック 2020-2021 3) 【小児への抗菌薬投与の用法・用量】薬剤 投与経路 通常 重症 セファゾリン 静注・筋注 1回 10~20 mg/kg、12 時間毎
(20~40 mg/kg/日)1回 33 mg/kg、8時間毎
(100 mg/kg/日)まで増量可■表5 小児感染症治療ハンドブック 2020-2021 4) 【新生児への抗微生物薬投与の用法・用量(海外)】
抗菌薬 推奨投与量(mg/kg/回) 推奨投与量(mg/kg/回) 体重≦2,000g 体重>2,000g 日齢28以降 髄膜炎 日齢7未満 日齢7以上 日齢7未満 日齢7以上 投与量 時間 投与量 時間 投与量 時間 投与量 時間 投与量 時間 投与量 時間 CEZ 25 12h 25 8h 50 12h 50 8h 50 8h - - 禁忌を含む注意事項等情報等については、電子添文をご参照ください。
1) 菊池賢・橋本正良 監修:表16 主な抗菌薬の小児への投与量,日本語版サンフォード感染症治療ガイド2024:p344【OPF001085】
2) JAID/JSC感染症治療ガイド・ガイドライン作成委員会:付表 新生児投与量,JAID/JSC感染症治療ガイド2023:p434 【OPF000870】
3) 尾内一信,石和田稔彦,岩田敏:3 感染症予防ならびに治療薬一覧/セフェム系薬(注射薬),小児感染症治療ハンドブック2020-2021:p102-103【CZF1421D12】
4) 尾内一信,石和田稔彦,岩田敏:4 新生児感染症の治療/新生児への抗微生物薬投与の用法・用量(海外),小児感染症治療ハンドブック2020-2021:p172-173【CZF1421D10】 -
細い静脈針でも投与はできますが、脂肪乳剤は生食などに比べて若干粘度が高いので細い針を通過しにくいと考えられます。そのため、24G のような細いゲージの静脈針で細い静脈に投与する場合、点滴速度が遅くなることがあります1)。
1) 大塚製薬工場 社内資料(脂肪乳剤の輸液セットからの流出時間)
-
セファゾリンNa点滴静注用1gバッグ「オーツカ」は母乳中へ移行することが報告されている1)ことから、授乳中の女性への投与は治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討してください2)。
16.3.2 乳汁中移行2)
授乳婦20例にセファゾリン2g静注したときの母乳中濃度は静注後2時間目1.3±0.9μg/mL、3時間目1.5±0.2μg/mL、4時間目1.2±1.0μg/mLであった。【参考】
Medications and Mothers, Milk ( MM ) 2023 の評価基準においては、カテゴリーL1『適合』とされています。3)
1) 長和彦:日本新生児学会雑誌,1979;15(1):231-233 【CZ10579A01】
2) セファゾリンNa点滴静注用1gバッグ「オーツカ」電子添文 2024年3月改訂(第1版)
3) 今日の治療薬2024:本書の使い方 便覧②(Briggs基準、豪州ADEC基準、Medications and Mothers, Milk 2023の評価基準)【OPF000937】 -
セファゾリンNa点滴静注用1gバッグ「オーツカ」の外袋は、ダブルバッグを 2 つ折りの状態にするために施されております。
酸素バリア等の安定性を保持する機能はありませんので、外袋を開封しても、内容成分の安定性には影響しません。
しかしながら、容器破損などのリスクを回避する意味から、外袋は使用時まで開封しないでください。1)1) セファゾリンNa点滴静注用1gバッグ「オーツカ」電子添文 2024年3月改訂(第1版)
-
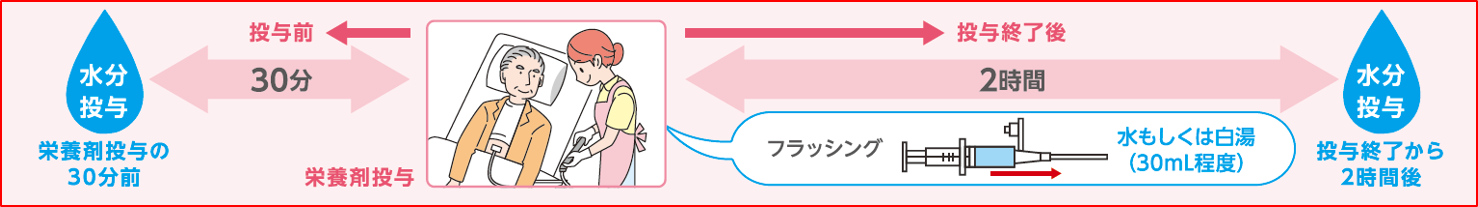
イノソリッド配合経腸用半固形剤およびラコールNF配合経腸用半固形剤では、多量の水分(液体)が流入することによる栄養剤の性状の変化を避けるため、間隔をおいて(栄養剤投与前30分、もしくは栄養剤投与終了から2時間後)水分を投与します。
ただし、チューブ詰まりを防ぐために、投与終了後、水もしくは白湯(30mL程度)でのフラッシングは必ず行ってください。※ 水分の追加の必要性や必要量は、主治医の指示に従ってください。
-
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与してください1)。
◆セファゾリンNa点滴静注用1gバッグ「オーツカ」の胎児へのリスク評価基準
①Briggs Drugs in Pregnancy & Lactation , 12th ed ( Briggs基準 ):【適合1】2)

② オーストラリア薬物評価委員会 ( ADEC ) の胎児危険度分類:【B1】2)

1) セファゾリンNa点滴静注用1gバッグ「オーツカ」電子添文 2024年3月改訂(第1版)
2) 今日の治療薬2024:本書の使い方 便覧②(Briggs基準、豪州ADEC基準、Medications and Mothers, Milk 2023の評価基準)【OPF000937】



